ПРОТЕОГЛИКАНЫ, углевод-белковые
компоненты животных тканей, в к-рых полисахаридные цепи ковалентно связаны с
белком, занимающим в молекуле центр. положение. В отличие от гликопротеинов,
углеводные цепи в молекулах П. всегда представлены мукополисахаридами
(хонд-роитинсульфатами, дерматансульфатом, кератансульфатом, гепарансульфатом
и гепарином).

В молекулах всех П., кроме
протеокератансульфата, углеводные цепи присоединены к гидроксильным группам
остатков L-серина полипептидной цепи через спсцифич. олигоса-харидную группировку,
не встречающуюся в др. углевод-белковых соед. (см. табл.). Напротив, протеокератан-сульфаты
сходны в этом отношении с гликопротеинами, поскольку их углеводные цепи являются
продолжением либо N-связанных олигосахаридных фрагментов гликопротеинов (протеокератансульфат
роговицы), либо О-связан-ных олигосахаридных цепей муцинового типа (протеокератансульфат
хряща).
Белковая часть молекул
П. может иметь упрощенный аминокислотный состав. Так, в белковых цепях протеогепа-ринов
преобладает чередование остатков серина и глицина. В других П. наряду с аналогичными
участками, несущими углеводные цепи, имеются домены с более разнообразным аминокислотным
составом, с помощью к-рых осуществляется комплексообразование с др. биополимерами
или закрепление П. в клеточной мембране. Примеры полного установления аминокислотной
последовательности белковой части П. вследствие серьезных эксперим. трудностей
пока немногочисленны.
Разные П. могут существенно
отличаться размером белковой части молекулы, а также числом, природой и расположением
углеводных цепей. В состав макромолекулы П могут одновременно входить гликозаминогликоновые
цепи неск. типов, а также О- и N-олигосахаридные фрагменты, характерные для
гликопротеинов. Многообразие П. затрудняет создание четкой классификации и номенклатуры
этих соединений. Обычно указывают тип ткани, из к-рой получен П., общий размер
молекулы (условно различают "большие" и "малые" П.),
преобладающую структуру углеводных цепей (возможны гибридные формы) и способность
к специ-фич. взаимодействиям с гиалуроновой к-той ("агрегирующие"
и "неагрегирующие" П.) Строение молекул различных П показаны на
рисунке
Выделение П из прир объектов
включает солюбилиза-цию тканей в 4 М р-ре хлорида гуанидиния, послед. центрифугирование
в градиенте плотности или выделение с использованием ионообменной хроматографии.
Для установления строения П проводят разделение углеводной и белковой частей
молекулы с помощью восстановит. расщепления под действием оснований в присут
NaBH4 (для О-гликозидов серина и треонина), ферментативного гидролиза
эндогли-козидазами или действием жидкого HF Освобожденную от углеводов пептидную
часть молекулы характеризуют физ.-хим. или иммунологич. методами и определяют
аминокислотную последовательность Альтернативный подход определение нуклеотидной
последовательности участка ДНК, кодирующего биосинтез белковой части П. Для
определения углеводной части П используется набор методов хим. (кислотный гидролиз,
периодатное окисление, де-заминирование с использованием HNO2) и
ферментативного расщепления на олигосахариды, а также спектроскопия ЯМР
Наиб. кол-ва П. содержатся
в соединит ткани животных, где эти в-ва, в первую очередь протеохондроитинсульфаты
и протеодерматансульфаты, в комплексе с гиалуроновой к-той, коллагеном и нек-рыми
др. белками обеспечивают необходимые физ.-мех. св-ва таких образований, как
кости, сухожилия, хрящи, межпозвоночные диски, кожа, стенки кровеносных
сосудов, роговица, стекловидное тело глаза и др.
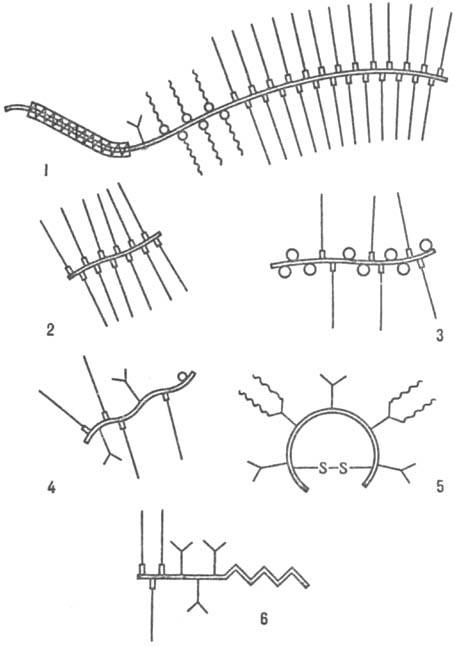
Схематич изображение структур
протеогликанов: 1 протеогликан хряща, 2 протеогепарин; 3 протеодерматансульфат
с олигосахаридами муцинового типа, 4 протеохондроитинсульфат или протеодерматансульфат
небольшой мол. массы, 5 протеокератансульфат роговицы; 6 - протеогепарансульфат
клеточной пов-сти. условные обозначения: = пептидная цепь, гидрофобный
участок полипептидной
цепи,
гидрофобный
участок полипептидной
цепи, участок
связывания с гиалуронатом,
участок
связывания с гиалуронатом,  N-
N-
Протеогепарансулъфаты-компоненты
клеточной пов-сти во мн. типах тканей и участвуют в обеспечении специфич. клеточной
адгезии и защите клеток от повреждения при инфекциях. Протеогепарин синтезируется
и накапливается в специализир. ("тучных") клетках, продукты его
ферментативного расщепления являются прир. регуляторами процесса свертывания
крови (антикоагулянтами). Для многих связанные
олигосахариды, О О-связанные олигосахариды муцинового типа, D участок связи
с белком GlcA—Gal2—Xyl—Ser —гликозаминогликуронановые цепи, цепи
кератансульфата П
отмечены отчетливые возрастные изменения. Известны многочисл нарушения биосинтеза
или катаболизма П., с к-рыми непосредственно связан ряд тяжелых заболеваний
(нарушения зрения, ф-ций костно-суставного аппарата, воспалит артриты, атеросклероз
и др.).
цепи
кератансульфата П
отмечены отчетливые возрастные изменения. Известны многочисл нарушения биосинтеза
или катаболизма П., с к-рыми непосредственно связан ряд тяжелых заболеваний
(нарушения зрения, ф-ций костно-суставного аппарата, воспалит артриты, атеросклероз
и др.).
Лит The biochemistry
of glycoproteins and proteoglycans, ed. by W J. Lennarz, N Y L., 1980; Biology
of proteoglycans. ed. by Т N. Wight, R.P Mecham, San Diego [a.o.], 1987 А
И Усов


