ПРОИЗВЕДЕНИЕ АКТИВНОСТЕЙ
(ПА), произведение термодинамич. активностей ионов в насыщ. р-ре
электролита (соль, гидроксид и т. п.) в данном р-рителе. Растворение твердого
в-ва AkBl с образованием ионов Az+ и
Вz-записывается как р-ция: AkBl(тв)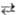 kAz+
(р-р) + lВz- (р-р). Согласно действующих масс закону, константа
равновесия
kAz+
(р-р) + lВz- (р-р). Согласно действующих масс закону, константа
равновесия
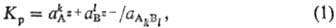
где аАz+,
аBz-, аАkBl - активности
катионов, анионов и растворенного в-ва соответственно. Т. к. в насыщ. р-рс аАkBl
=1. П. а. для ионов
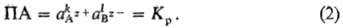
П. а. зависит от т-ры и
природы р-рителя, а при фиксир. т-ре в данном р-рителе П. а. для каждой соли-пост.
величина, характеризующая ее растворимость. Если в р-ре произведение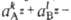 >
ПА, твердое соед. АkВl выпадает в
осадок, если же
>
ПА, твердое соед. АkВl выпадает в
осадок, если же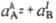 -
< ПА, в-во АkВl переходит
в р-р. Если выполняется условие (1), р-р и твердое в-во находятся В равновесии.
-
< ПА, в-во АkВl переходит
в р-р. Если выполняется условие (1), р-р и твердое в-во находятся В равновесии.
В аиалит. химии вместо
строгого термодинамич. понятия ПА используется произведение растворимости (ПР),
равное произведению молярных концентраций ионов [Az+]k
и [Вz-]l в р-ре соли АkВl.
ПР связано с ПА через коэф. активности 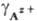 и
и 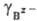
ПА =b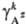 +
+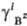 -
[Аz+]k[Вz-]l =
-
[Аz+]k[Вz-]l =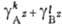 -
ПР.
-
ПР.
В реальном р-ре ПР, в отличие
от ПА, не является пост. величиной: для данного р-рителя при пост. т-ре (т.е.
при ПА = const) присутствие в р-ре других растворенных в-в, помимо АkВl
, или изменение концентраций ионов Az+ и Вz-приводит
к изменению коэф. активности и, следовательно, к изменению ПР. В разб. р-рах
электролитов, согласно Девая-Хюккеля теории, коэф. активности связаны
с ионной силой р-ра
I (напр.,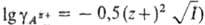 ,
что позволяет переходить от значений ПА к значениям ПР. На практике обычно считают
р-ры идеальными, т. е. принимают ПА = = ПР = const ПР связано с р-римостью S
(обычно измеряемой в моль/л) соотношением:
,
что позволяет переходить от значений ПА к значениям ПР. На практике обычно считают
р-ры идеальными, т. е. принимают ПА = = ПР = const ПР связано с р-римостью S
(обычно измеряемой в моль/л) соотношением:
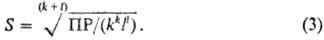
Это соотношение позволяет
использовать значение ПР для подбора условий растворения и осаждения в-в. Важно
учитывать, что условие ПР = [Аz+]k[Вz-]l
= const может выполняться при разл. значениях каждой из концентраций [Аz+]
и [Вz-]. Для осаждения соли АkВl
из ненасыщ. р-ра обычно
добавляют в р-р соль, имеющую с АkВl
общий катион или анион, напр. AD или СВ. При этом концентрация ионов Аz+
(или Вz-) в р-ре возрастает, произведение концентраций [Az+]k[Bz-]l
превышает ПР и начинается выпадение в осадок АkВl.
Наоборот, полный переход АkВl в р-р
достигается связыванием одного из ионов (Аz+ или Bz-)
в недиссоциируемый комплекс в р-ре, что приводит к снижению концентрации этого
иона и выполнению условия [Az+]k[Bz-]l<
ПР. Третий способ регулирования р-римости - изменение ионной силы р-ра (т. наз.
солевой эффект), когда к р-ру добавляется электролит CD, не имеющий общих ионов
с АkВl Это приводит к росту ионной
силы, уменьшению g и, следовательно, увеличению р-римости.
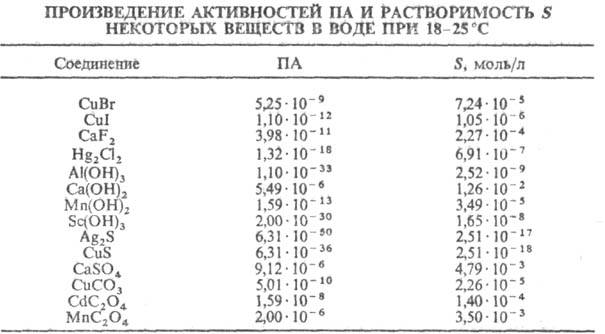
В таблице приведены значения
ПА и р-римости S нек-рых в-в в воде при 18-25 °С; стандартное состояние
для определения активностей ионов-р-р единичной концентрации (1 моль/л).
Лит.: Лурье Ю. Ю.,
Справочник по аналитической химии, М., 1979.
М. В. Коробов.


