ПОТЕНЦИОМЕТРИЯ (от
лат. potentia-сила, мощность и греч. metreo- измеряю), электрохим. метод исследования
и анализа в-в, основанный на зависимости равновесного электродного потенциала
Е от термодинамич. активности а компонентов электрохим. р-ции:
aА + bВ + ... + nе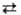 mМ + рP
+ Эта зависимость описывается Нернста уравнением
mМ + рP
+ Эта зависимость описывается Нернста уравнением
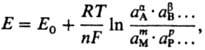
где Е0 стандартный
потенциал, R-газовая постоянная, Т-абс. т-ра, F-постоянная Фарадея,
n-число электронов, участвующих в р-ции, a, b, ..., т, р
...-стехиометрич. коэф. при компонентах р-ции А, В, ..., М, Р (к-рыми м.б.
ионы и молекулы в жидкой, твердой или газовой фазе). Активности твердых и газообразных
компонентов и р-рителей принимают за единицу.
При потенциометрич. измерениях
составляют гальванич. элемент с индикаторным электродом (см. Электроды в
электрохимии), потенциал к-рого зависит от активности хотя бы одного из
компонентов электрохим. р-ции, и электродом сравнения и измеряют электродвижущую
силу (эдс) этого элемента (см. Электрохимические цепи).
В П используют гальванич.
элементы без переноса, когда оба электрода помещают в один и тот же исследуемый
р-р, и с переносом, когда электроды находятся в разных р-рах, имеющих между
собой электролитич. контакт. Последний осуществляют таким образом, что р-ры
могут смешиваться друг с другом только путем диффузии. Обычно их разделяют пористой
керамической или пластмассовой перегородкой
или прочно пришлифованной стеклянной муфтой. Элементы без переноса используют
в осн. для измерения констант равновесия хим. р-ций, констант диссоциации электролитов,
констант устойчивости комплексных соед., произведений р-римости, стандартных
электродных потенциалов, а также активностей и коэф. активности ионов. Элементы
с переносом используют для определения "кажущихся" констант равновесия
(поскольку при этом не учитывают жидкостной потенциал), активностей и коэф.
активности ионов, а также в потенциометрич. методах анализа.
Среди этих методов различают
прямую П. и потенциометрич. титрование. Прямая П. применяется для непо-средств.
определения а ионов (напр., Ag+ в р-ре AgNO3) по
значению Е соответствующего индикаторного электрода (напр., серебряного);
при этом электродный процесс должен быть обратимым. Исторически первыми методами
прямой П. были способы определения водородного показателя рН (см. рН-Метрия).
Появление мембранных ионоселективных электродов привело к возникновению
ионометрии (рХ-мет-рии), где рХ = — lg ах, ах-активность
компонента X элект-рохим. р-ции. Иногда рН-метрию рассматривают как частный
случай ионометрии. Градуировка шкал приборов потенциометров по значениям рХ
затруднена из-за отсутствия соответствующих стандартов. Поэтому при использовании
ионоселективных электродов активности (концентрации) ионов определяют, как правило,
с помощью градуировоч-ного графика или методом добавок. Применение таких электродов
в неводных р-рах ограничено из-за неустойчивости их корпуса и мембраны к действию
орг. растворителей.
К прямой П. относится также
редоксметрия - измерение стандартных и реальных окислит.-восстановит. потенциалов
и констант равновесия окислит.-восстановит. р-ций. Окислит.-восстановит. потенциал
зависит от активностей окисленной (О и восстановленной (aвос)
форм в-ва. Редокс-метрию применяют также для определения концентрации ионов
в р-рах. Методом прямой П. с использованием металлич. электродов изучают механизм
и кинетику р-ций осаждения и комплексообразования.
Прямая П. обладает важными
достоинствами. В процессе измерений состав анализируемого р-ра не меняется.
При этом, как правило, не требуется предварит. отделения определяемого в-ва.
Метод можно легко автоматизировать, что позволяет использовать его для непрерывного
контроля технол. процессов.
Более распространены методы
потенциометрич. титрования, с помощью к-рых определяют широкий круг в-в в водных
и неводных средах. В этих методах регистрируют изменение потенциала индикаторного
электрода в процессе титрования исследуемого р-ра стандартным р-ром реагента
(см. Титриметрия)в зависимости от объема последнего. Потенциометрич.
титрование проводят с использованием разл. р-ций: кислотно-основного и окислит.-восстановит.
взаимодействий, осаждения и комплексообразования. В методах кислотно-основного
титрования в качестве индикаторного можно использовать любой электрод, обратимый
к ионам Н+ (водородный, хингидронный, сурьмяный, стеклянный); наиб.
распространен стеклянный электрод. Окис-лит.-восстановит. титрование проводят
с электродами из благородных металлов (чаще всего с платиновым). В методах осадительного
и комплексометрич. титрования индикаторный (ионоселективный или металлич.) электрод
должен быть обратимым относительно одного из ионов, участвующих в р-ции. Вблизи
точки эквивалентности наблюдается резкое изменение (скачок) электродного потенциала
E, обусловленное заменой одной электрохим. р-ции другой с соответствующим
изменением E0. Напр., при титровании ионов Сl-
р-ром AgNO3 с серебряным индикаторным электродом до точки эквивалентности
при избытке ионов Cl ~ потенциал электрода определяется р-цией AgCl + e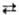 Ag
+ Cl- с Е = 0,222 — 0,059 lg aCl_, а после
точки эквивалентности при избытке ионов Ag+-р-цией Ag+
+ e
Ag
+ Cl- с Е = 0,222 — 0,059 lg aCl_, а после
точки эквивалентности при избытке ионов Ag+-р-цией Ag+
+ e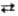 Ag с E
= 0,799 + + 0,059 lg АAg+
Ag с E
= 0,799 + + 0,059 lg АAg+
Потенциометрич. титрование
имеет ряд преимуществ по сравнению с титриметрич. методами, в к-рых применяют
химические индикаторы: объективность и точность в установлении конечной
точки титрования, низкая граница определяемых концентраций, возможность титрования
мутных и окрашенных р-ров, возможность дифференцированного (раздельного) определения
компонентов смесей из одной порции р-ра, если соответствующие Е0
достаточно различаются. Потенциометрич. титрование можно проводить автоматически
до заданного значения потенциала, кривые титрования записывают как в интегральной,
так и в диффе-ренц. форме. По этим кривым можно определять "кажущиеся"
константы равновесия разл. процессов.
Для определения компонентов
обратимых систем, когда на электродах устанавливаются равновесные значения потенциалов,
потенциометрич. титрование проводят при силе тока I = 0. В случае необратимых
электродных процессов исследуемый р-р титруют с одним или двумя поляризованными
электродами, т.е. при контролируемой силе тока I . 0. В этом случае
Е устанавливается быстро и расширяется круг используемых титрантов и
определяемых соединений. Потенциометрич. методы анализа широко используют для
автоматизации контроля технол. процессов в хим., нефтехим., пищ. и др. отраслях
пром-сти, в медицине, биологии, геологии, а также при контроле загрязнений окружающей
среды.
Лит.. Плэмбек Д.,
Электрохимические методы анализа, пер. с англ., М., 1985; Агасян П. К., Николаева
Е. Р., Основы электрохимических методов анализа (нотенциометрический метод),
М., 1986; Справочное руководство по применению ионоселективных электродов, пер.
с англ., М., 1986.
Л. Н. Быкова.


