ПОРФИРИНЫ, прир.
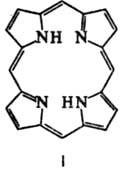
макрогетероциклич. пигменты, содержащие в молекуле цикл порфина (ф-ла I). Формально
получаются из порфина замещением атомов Н в цикле на разл. орг. радикалы. К
П. относят такие важные пигменты, как гемо-глобины, хлорофиллы, цитохромы и
нек-рые др. ферменты (каталаза, пероксидаза). Обнаружены П. также в выделениях
животных, оперении птиц, скорлупе яиц, раковинах моллюсков, нефтях, битумах,
ископаемых орг. остатках, метеоритах.
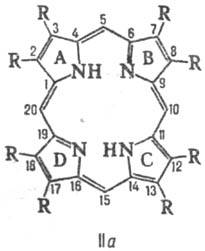
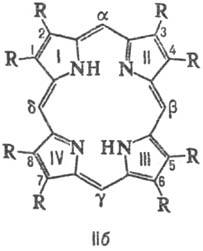
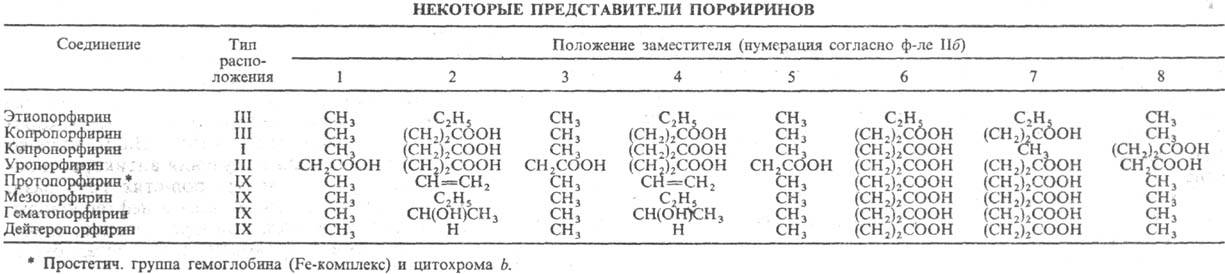
Атомы С в П. нумеруют,
согласно но менклатурам ИЮПАК (ф-ла Па) или Фишера (Ш). Четыре атома С (5, 10,
15 и 20 в ф-ле Ш), связывающие пиррольные циклы, наз. мезо-угле-родными
атомами.
Число изомеров положения
для П. определяется кол-вом заместителей и их расположением в молекуле. Для
П. с двумя заместителями (напр., СН3 и С2Н5)
при условии, что оба заместителя присутствуют в каждом пиррольном цикле, возможны
4 типа изомеров. При наличии трех разл. заместителей число типов возрастает
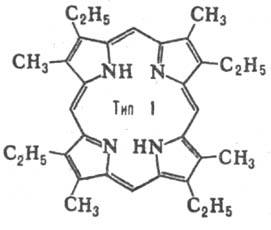
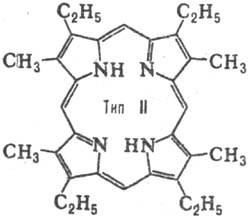
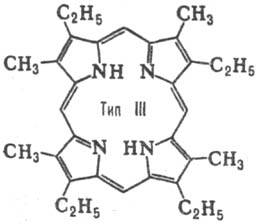
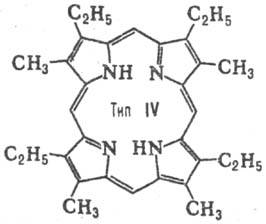
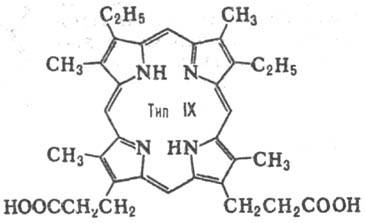
до 15. Природные П. с двумя заместителями обладают гл. обр. расположением типа
III, с тремя-типа IX (см. табл.).
Порфин и П.-высокоплавкие
интенсивно окрашенные соед. (гл. обр. темно-красного цвета); т. разл. порфина
360°С, П.-ок. 500°С П. хорошо раств. в СНС13, ДМФА, хуже
в этаноле и метаноле, не раств. в воде. Молекулы П. плоские и обычно ассоциированы
вследствие образования водородных связей. В УФ спектре П. lмакс
~ 400 нм (т. наз. полоса Соре, е 400 000), 500 600 нм (е 15 000 и менее)
П.-ароматич. структуры;
обладают высокой энергией сопряжения (840 кДж/моль), что проявляется в стабильности
соединений. Для порфиринового цикла характерно наличие двух таутомерных форм:
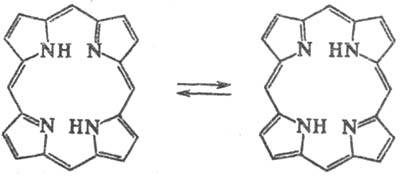
П.-амфотерные соед.; атомы
N в молекуле способны присоединять протоны с образованием моно- или дикатио-нов,
обе группы NH-отщеплять протоны с образованием моно- или дианионов: 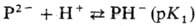
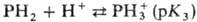 РН2
РН2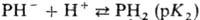 порфирин,
Р2--дианион,
порфирин,
Р2--дианион,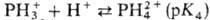
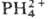 -дикатион
П.-слабые к-ты; рК1
и рК2 (для этиопорфирина) +16, рК3
октаалкилпорфиринов ок. +5,5 (2,5%-ный водный р-р додецилсульфата Na).
-дикатион
П.-слабые к-ты; рК1
и рК2 (для этиопорфирина) +16, рК3
октаалкилпорфиринов ок. +5,5 (2,5%-ный водный р-р додецилсульфата Na).
При взаимод. с солями металлов
П. образуют металло-порфирины, наиб. важный из к-рых-гем, или ферропрото-порфирин
(см. Гемоглобин); наиб. важный гидрир. металло-порфирин-хлорофилл.
Металлопорфирины легко вступают в р-ции электроф. замещения, гл. обр. по
мезо-положениям. Для свободных П. эти р-ции затруднены вследствие образования
в кислой среде дикатиона, не вступающего в электроф. р-ции.
П. и их металлокомплексы
легко восстанавливаются. Легче всего протекает электрохим. восстановление с
образованием моно- и дианионов, к-рые являются сильными ну-клеофилами и быстро
реагируют (гл. обр. по мезо-углерод-ным атомам) с донорами протонов и
такими электрофилами, как СН3I. Мягкое гидрирование цикла П. приводит
к хлоринам (ф-ла III) и флоринам (IV), более глубокое-к бактериохлоринам (V),
порфодиметенам (VI), порфомете-нам (VII) и порфириногенам (VIII).
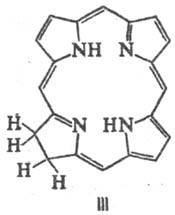
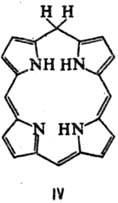
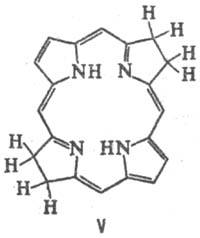
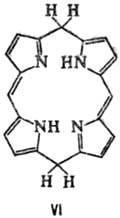
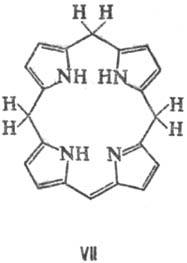
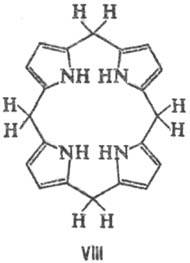
Если в П. присутствуют
ненасыщ. заместители, напр. ви-нильная группа, то до порфириногенов такие соед.
восстанавливаются амальгамой Na. Обработка порфириногенов О2 воздуха
на свету, иодом или 2,3-дихлор-5,6-дицианобен-зохиноном приводит к их переходу
в П. Под действием HI происходит, как правило, разрыв кольца П. и образование
смеси пирролов.
Под действием мягких окислителей
или электрохимически П. и их металлокомплексы образуют продукты окисления-катион-радикалы,
под действием сильных окислителей (напр., СrO3, КМnО4)
происходит разрыв кольца:
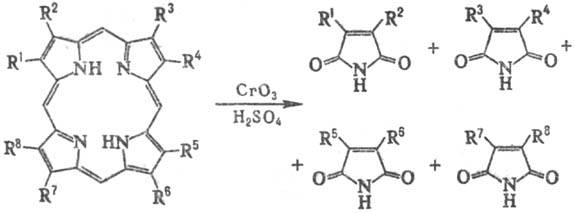
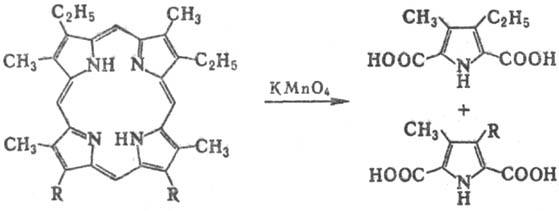
Окислит. расщепление П.
в организме приводит к образованию желчных пигментов. П. сравнительно
легко метилируются по атомам N, напр.
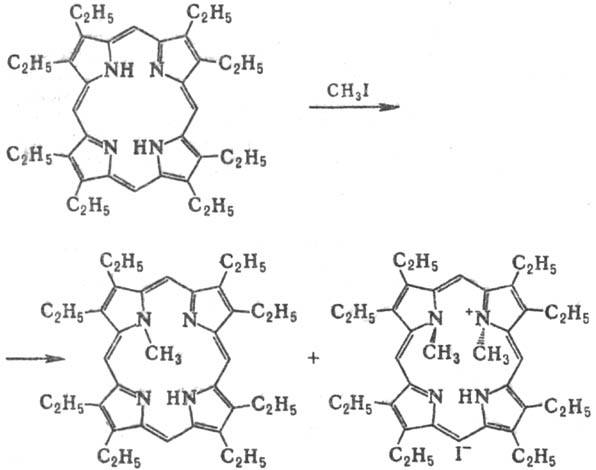 •
•
Метальные группы испытывают
пространств. затруднения, вследствие чего макроцикл оказывается "гофрированным".
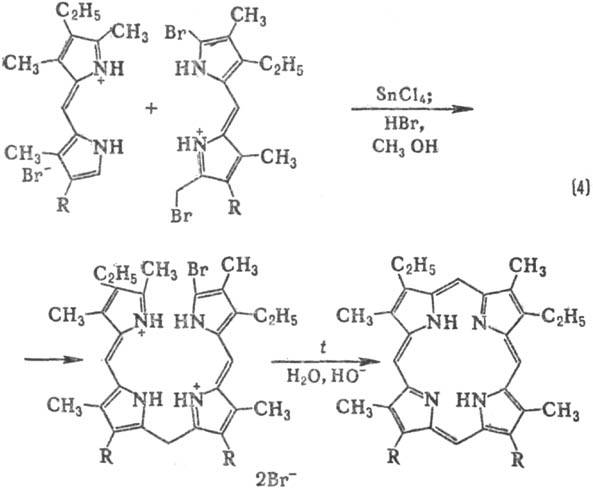
Методы синтеза П.: конденсация монопирролов с альдегидами (р-ция 1); самоконденсация
монопирролов, содержащих в положении 2 группу СН2Х, где X = О Ас,
ОН, Сl, Вr, N(CH3)2 (р-ция 2); конденсация дипиррилметенов
и дипир-рилметанов (3а и 3б); конденсация тетрапиррольных ингер-медиатов,
к-рые м. б. получены, в свою очередь, из дипиррилметенов, дипиррилметанов или
ступенчатым синтезом из монопирролов (напр., р-ция 4).
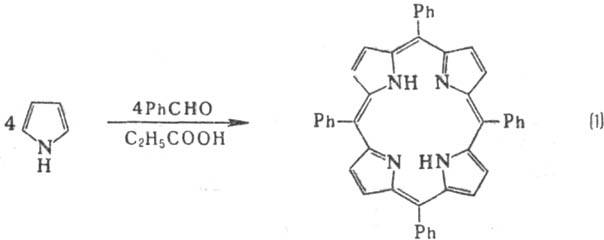
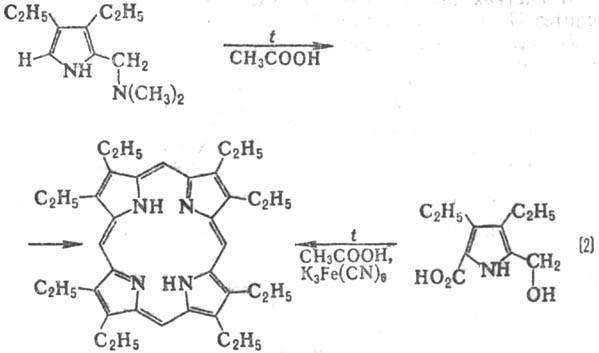
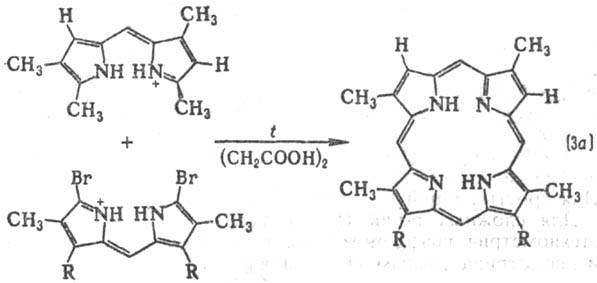
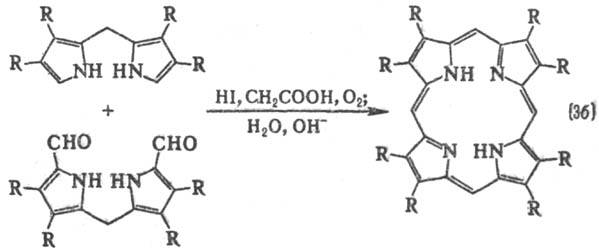
В клетках растительных
и животных организмов биосинтез П. осуществляется из глицина и янтарной к-ты.
П.- основа нек-рых прир.
красителей, модельные соед. для изучения процесса оксигенации при фотосинтезе,
лек. препараты в терапии рака (напр., димер гематопорфирина-фото-фрин); металлокомплексы
П.-катализаторы окисления и эпоксидирования углеводородов.
Лит.: Химия биологически
активных природных соединений, под ред. Н.А. Преображенского и Р.П. Евстигнеевой,
М., 1976, с. 100-84; Общая органическая химия, пер. с англ., т. 8, М., 1985,
с. 388-413; Порфирины: структура, свойства, синтез, под ред. Н.С. Ениколопяна,
М., 1985; Порфирины: спектроскопия, электрохимия, применение, под ред. Н.С.
Ениколопяна, М., 1987; Falk J. E., Porphyrins and meta!lopcrphyrins, Amst.-L.-N.
Y., 1964; Dolphin D. (ed.), The Porphyrins. Structure and synthesis, v. 1, pt
A, L.-N. Y., 1978. P.
П. Евстигнеева.


