ПОЛОНИЙ (от лат.
Polonia-Польша, родина М. Скло-довской-Кюри; лат. Polonium) Po, радиоактивный
хим. элемент VI гр. периодич. системы, ат. н. 84, ат. м. 208,9824. Стабильных
изотопов не имеет. Известно 27 изотопов с мас. ч. 192-218. Наиб. долгоживущие
изотопы: 209Ро(T1/2102 года), 208Ро
(Т1/2 2,9 года) и 210Ро (Т1/2
138,3 сут) - a-излучатели. Изотопы с маc. ч. 210-218 входят в прир.
радиоактивные ряды. Конфигурация внеш. электронных оболочек атома 5s25p65d106s26p4;
степени окисления — 2, +2, +4 (наиб. устойчивая) и +6; электроотрицательность
по Полингу 1,76; атомный радиус 0,153 нм, ионные радиусы (расчетные) для Ро6+
0,067 нм, Ро4+ 0,104 нм. Содержание в земной коре ок. 2·10 -14%
по массе.
Свойства. П. - мягкий серебристо-белый
металл. Известны две кристаллич. модификации П.: низкотемпературная a-форма
с кубич. решеткой, а = 0,3359 нм; b-форма, устойчивая выше 36 °С,
решетка ромбоэдрич., а = 0,3366 нм, а = 98,08°; т. пл. 254 °С,
т. кип. 949 °С; вычисленная плотн. 9,136 г/см3;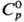 26,4
Дж/(моль·К);
26,4
Дж/(моль·К);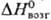 72,8
кДж/моль;
72,8
кДж/моль; 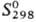 62,8
ДжДмоль • К); ур-ние температурной зависимости давления пара металлического
П.: 1gp(атм) = 4,553-5778/Т. На воздухе окисляется; реагирует
с р-рами к-т с образованием ионов Ро(П) (розового цвета), к-рые быстро окисляются
до Po(IV) (желтого цвета); с Н2 дает летучий гидрид РоН2.
Известны полониды металлов, к-рые получают нагреванием соответствующих металлов
с парами П. при 400-1000°С. Характеристики нек-рых полонидов приведены в
таблице.
62,8
ДжДмоль • К); ур-ние температурной зависимости давления пара металлического
П.: 1gp(атм) = 4,553-5778/Т. На воздухе окисляется; реагирует
с р-рами к-т с образованием ионов Ро(П) (розового цвета), к-рые быстро окисляются
до Po(IV) (желтого цвета); с Н2 дает летучий гидрид РоН2.
Известны полониды металлов, к-рые получают нагреванием соответствующих металлов
с парами П. при 400-1000°С. Характеристики нек-рых полонидов приведены в
таблице.
Диоксид РоО2
существует в двух кристаллич. модификациях: ниже 54°С-в желтой форме с гранецентрир.
кубич. решеткой (а = 0,5638 нм); при более высокой т-ре-в красной форме
с тетрагон, решеткой (а = 0,545 нм, с = = 0,836 нм); разлагается при
500 °С в вакууме, восстанавливается до металла водородом или HN3
при 250 °С; получают нагреванием металла в атмосфере О2 при 250
°С дегидратацией гидроксида П. при той же т-ре и нагреванием сульфатов или
селенатов П. выше 550 °С. Известен монооксид РоО-твердое в-во черного цвета,
образуется при самопроизвольном разложении PoSO3 или PoSeO3.
Термин, разложением соответствующих галогенидов Po(IV) при 200 °С в вакууме
или их восстановлением водородом при 200°С, SO2 и H2S
при 25°С получают дихлорид РоС12 (темные рубиново-красные кристаллы
с ромбич. решеткой, а = 0,366 нм, b = 0,434 нм, с = 0,449
нм), дибромид РоВr2 (пурпурно-коричневые кристаллы).
|
ХАРАКТЕРИСТИКА
ПОЛОНИДОВ |
|||||||
|
Соединение |
Сингония |
Параметры |
решетки |
Плотн. (расчетная),
г/см3 |
Т. разл., |
||
|
а, им |
с, нм |
||||||
| РbРо |
Кубич. |
0,659 |
- |
9,6 |
600 |
||
| HgPo |
To же |
0,625 |
— |
11,1 |
— |
||
| ZnPo |
— "— |
0,628 |
— |
7,39 |
400* |
||
| Na2Po |
— "— |
0,747 |
— |
4,08 |
— |
||
| PtPo |
Гексагон. |
0,4104 |
0,1366 |
12,47 |
450-600 |
||
| NiPo |
То же |
0,3973 |
0,1425 |
11,53 |
— |
||
| BePo |
Кубич. |
0,5827 |
— |
7,35 |
- |
||
| BaPo |
То же |
0,7119 |
— |
6,3 |
— |
||
| CaPo |
— "— |
0,6514 |
— |
6,0 |
— |
||
| MgPo |
Гексагон. |
0,4345 |
0,7060 |
6,7 |
— |
||
|
* T-pa возгонки. |
|||||||
Тетрахлорид РоС14-ярко-желтые
кристаллы с моноклинной решеткой; т. пл. 300 °С, т. кип. 390°С. Тетрабромид
РоВr4-ярко-красные кристаллы; т. пл. 330 °С, т. кип. 360°С/200
ммрт.ст. Тетраиодид РоI4-летучее в-во черного цвета. Тетрагалогениды
П. раств. в этаноле, ацетоне. Синтезируют тетрагалогениды взаимод. металлического
П. соотв. с сухим С12 при 200 °С, парами Вr2 при 250
°С, действием сухого I2 на РоО2 при 200 °С. Упариванием
р-ров РоС14 с соответствующим галогенидом одновалентного металла
или нагреванием РоС14 с галогенидом аммония получены гексахлорополонаты:
Cs2[PoCl6]-кристаллы с гранецентрир. кубич. решеткой (a=1,059нм),
(NH4)2[PoCL] с кубич. решеткой (а = 1,033 нм) и
[(CH3)4N]2[PoCl6]-c кубич. решеткой.
В кислых водных р-рах стандартные
электродные потенциалы для пары Po(II)/Po(IV) 0,798 В, для Po(II)/Po(VI) 1,16
В, для Po(IV)/Po(VI) 1,524 В.
Получение. 10Ро
в граммовых кол-вах получают облучением металлич. 209Вi нейтронами
в ядерных реакторах, а микроколичества П.-из отходов переработки урановых руд.
209Ро образуется при облучении 209Bi протонами в циклотроне.
Выделяют П. экстракцией, ионным обменом, электроосаждением и возгонкой. Металлический
П. получают разложением в вакууме PoS или РоО2 при 500 °С.
Применение. 210Ро-источник
энергии в атомных батареях (1 см3 210Ро выделяет 1210
Вт тепловой энергии), к-рые используют в космич. аппаратах, а также в переносных
устройствах; в смеси с Be и В П. применяют для изготовления ампульных источников
нейтронов.
П. высокотоксичен. ПДК
в открытых водоемах и воздухе рабочих помещений соотв. 1,11·10-3
и 7,4·10 -3 Бк/л. Миним. значимая активность 3,7·103 Бк
(категория 4).
Впервые П. выделен из урановой
смоляной руды П. Кюри и М. Склодовской-Кюри в 1898.
Лит. Бэгнал К ,
Химия редких радиоактивных элементов, пер. с англ., М., 1960; Bagnall К W.,
"Radiochimica Acta", 1983, v 32, № 1-3, p. 153 61
Б. Ф Мясоедов


