ПЛОТНАЯ УПАКОВКА
атомов и молекул, способ модельного описания кристаллических структур. Рассматривают
т. наз. шаровые (атомные) упаковки, к-рые характерны для структур многих сравнительно
простых по составу неорг. B-B, и мол. упаковки, свойственные молекулярным
кристаллам.
Шаровые упаковки подразделяются
на плотнейшие шаровые упаковки (ПШУ) и плотные шаровые кладки (ПШК). ПШУ построены
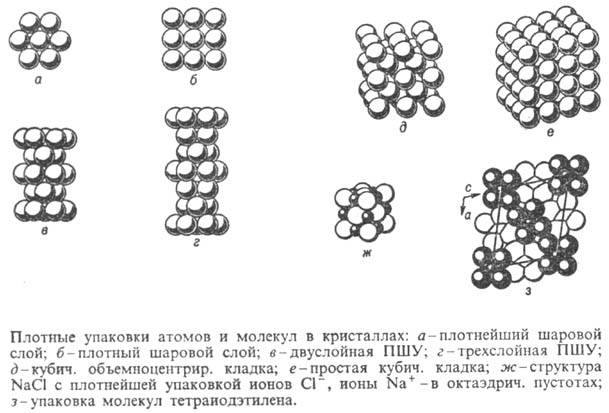
из плотнейших слоев, показанных на рис., а, ПШК - из тех же слоев или
из плотных слоев, показанных на рис., б. В ПШУ реализуется плотнейшее
наложение слоев, при к-ром каждый шар касается трех слоев соседнего слоя; в
итоге каждый шар в ПШУ имеет координац. число 12. Число слоев, приходящихся
на период ПШУ, перпендикулярный плоскости слоя, наз. слойностью упаковки. В
кристаллах наиб. распространены двуслойная (рис., в)и трехслойная
(рис., г)ПШУ. В ПШК шары располагаются менее компактно и имеют более
низкие координац. числа: 8-в объемноцентрир. кубич. кладке (рис., д), 6-в
простой кубич. кладке (рис., е).
Очень многие структуры
металлов и интерметаллич. соед. построены по принципу ПШУ или ПШК. Так, в кристаллах
Mg, Be, Ru, Os и др. реализуется двуслойная ПШУ, в кристаллах Cu, Ag, Au, Ni
и др.-трехслойная ПШУ, в La-четырехслойная ПШУ, в a-Fe, Na, К, Ba, Nb,
Та и др.-объемноцентрированная кубич. ПШК, в кристаллах а-Ро-простая кубич.
ПШК. По закону ПШУ располагаются также атомы в структурах отвердевших благородных
газов. В ин-терметаллиде Cu3Au атомы Cu и Au совместно образуют трехслойную
ПШУ.
Многие бинарные и более
сложные структуры описывают в терминах ПШУ и ПШК, при этом считают, что атомы
одного сорта располагаются в центрах шаров, образующих упаковку, а атомы др.
сорта располагаются в центрах пустот. При этом шары, образующие ПШУ и ПШК, обычно
оказываются несколько раздвинутыми (с учетом атомных радиусов). Во всех ПШУ
присутствуют пустоты двух типов - тетраэдрические (окруженные по тетраэдру четырьмя
шарами) и октаэдрические (окруженные по октаэдру шестью шарами),
причем на каждый шар упаковки приходится две тетраэдрические и одна октаэдрическая
пустоты. Аналогично рассматривают пустоты в ПШК (напр., в простой кубич. ПШК
присутствуют кубич. пустоты-на каждый шар одна пустота). Примеры бинарных структур,
описываемых в терминах ПШУ и ПШК: NaCl - трехслойная ПШУ (рис., ж), образуемая
атомами Cl, где атомы Na занимают все октаэдрич. пустоты; CdCl2-аналогичная
ПШУ, где атомы Cd занимают половину октаэдрич. пустот послойно; CaF2-простая
кубич. кладка из атомов F, где атомы Ca занимают половину кубич. пустот в шахматном
порядке.
Согласно принципу П. у.
молекул, сформулированному А. И. Китайгородским, молекулы, моделируемые внеш.
контуром пересекающихся ван-дер-ваальсовых сфер атомов, в кристаллах "касаются",
т.е. не проникают друг в друга и не висят в пустоте. Расстояния между контактирующими
атомами соседних молекул обычно отличаются от суммы ван-дер-ваальсовых радиусов
не более чем на 5%. При этом молекулы (рис., з)располагаются достаточно
плотно (выступ к впадине). Коэф. плотности упаковки k = zVмол/Vяч,
где z -число молекул в ячейке, VMOJI-объем молекулы,
Vяч-объем ячейки, близок к 0,7.
Лит. см. при ст.
Кристаллы. П. M. Зоркий.


