ПИТТИНГОВАЯ КОРРОЗИЯ,
коррозия металлов, ведущая к образованию питтингов [англ. pitting, от pit-покры-вать(ся)
ямками], т.е. язв, полостей в металле, начинающихся с его поверхности. Питтинги
возникают гл. обр. в защитном слое (нанесенном или образовавшемся естеств. образом)
по местам разл. дефектов (трещин от внутр. напряжений, пор, микровключений,
выхода на пов-сть границ зерен, дислокаций и т. п.). В зависимости от продолжительности
П. к. и др. факторов глубина и поперечник пит-тинга могут изменяться от мкм
до см. Питтинги могут нарушать функционирование самых разл. изделий-от тонких
мембран и проводников микросхем до толстостенных аппаратов, емкостей и труб.
Среди причин коррозионных повреждений хим. и энергетич. оборудования доля П.
к. составляет от 15 до 50%. От питтингов часто развиваются коррозионные трещины
(см. Коррозия под напряжением), что значительно повышает опасность П.
к.
П. к. протекает по электрохим.
механизму (см. Коррозия металлов). Линейная скорость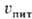 углубления питтинга при стабилизировавшейся П. к. металла M может достигать
10-104 мм/год. Это обусловлено тем, что в питтинге локализуется анодная
р-ция M = Mz+ + zе (z-зарядовое число иона), а катодная р-ция
чаще всего протекает в намного большей по размерам зоне пов-сти вокруг питтинга,
если защитный слой достаточно электропроводен. Таким св-вом обладают MH. пассивирующие
слои (см. Пассивность металлов), окалина, возникающая при высокотемпературной
газовой коррозии, катодные металлич. покрытия и др. Наиб. специфична
по своему механизму П. к. пассивных металлов, обычно связанная с воздействием
того или иного активирующего аниона A (Cl-, Br -, CNS-,
углубления питтинга при стабилизировавшейся П. к. металла M может достигать
10-104 мм/год. Это обусловлено тем, что в питтинге локализуется анодная
р-ция M = Mz+ + zе (z-зарядовое число иона), а катодная р-ция
чаще всего протекает в намного большей по размерам зоне пов-сти вокруг питтинга,
если защитный слой достаточно электропроводен. Таким св-вом обладают MH. пассивирующие
слои (см. Пассивность металлов), окалина, возникающая при высокотемпературной
газовой коррозии, катодные металлич. покрытия и др. Наиб. специфична
по своему механизму П. к. пассивных металлов, обычно связанная с воздействием
того или иного активирующего аниона A (Cl-, Br -, CNS-,
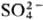 ,
, 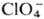 и др.) на активные центры пассивирующего слоя (дефекты). Такие центры периодически
выходят на пассивную пов-сть по мере се растворения, образуя участки с кратковременно
повыш. локальной скоростью растворения, к-рые могут стать зародышами питтингов.
В водных и мн. водно-орг. средах превращение зародыша в устойчиво развивающийся
питтинг обычно происходит при условии, что потенциал коррозии металла превышает
нек-рое значение, наз. критич. потенциалом питтингообразования Епк
(миним. потенциал П. к.). Для металла, потенциал коррозии к-рого находится
в пассивной или активной области (Екор или Е'корсоотв.,
рис. 1) (см. Анодное растворение), при достижении Епк
происходит резкий рост анодного тока растворения. Вероятность развития зародыша
питтинга превышает вероятность его гибели (репассивации) вследствие того, что
вблизи активных центров из-за ускоренного миграц. подвода анионов-активаторов
А повышена их локальная концентрация в р-ре, а на самих центрах соотв. адсорбция.
В результате при E
и др.) на активные центры пассивирующего слоя (дефекты). Такие центры периодически
выходят на пассивную пов-сть по мере се растворения, образуя участки с кратковременно
повыш. локальной скоростью растворения, к-рые могут стать зародышами питтингов.
В водных и мн. водно-орг. средах превращение зародыша в устойчиво развивающийся
питтинг обычно происходит при условии, что потенциал коррозии металла превышает
нек-рое значение, наз. критич. потенциалом питтингообразования Епк
(миним. потенциал П. к.). Для металла, потенциал коррозии к-рого находится
в пассивной или активной области (Екор или Е'корсоотв.,
рис. 1) (см. Анодное растворение), при достижении Епк
происходит резкий рост анодного тока растворения. Вероятность развития зародыша
питтинга превышает вероятность его гибели (репассивации) вследствие того, что
вблизи активных центров из-за ускоренного миграц. подвода анионов-активаторов
А повышена их локальная концентрация в р-ре, а на самих центрах соотв. адсорбция.
В результате при E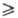 Епк
пассивирующий слой MOx теряет энергетич. устойчивость
в системе M (MOx) - А - H2O. Полагают, что при
E
Епк
пассивирующий слой MOx теряет энергетич. устойчивость
в системе M (MOx) - А - H2O. Полагают, что при
E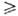 Епк
достигается настолько высокая локальная скорость анодного растворения
в активных центрах (iпит), что она превышает скорость процесса
репассивации, поскольку ему препятствует образование при растворении металла
агрессивного кон-центрир. кислого р-ра соли M и А или солевого (оксисолево-го)
слоя, обладающего высокой катионной проводимостью. Пока при росте питтинга значения
iпит, связанные со скоростью uпит в соответствии
с законом Фарадея, остаются достаточно высокими, процесс самоподдерживается.
Важнейшую роль играет каталитич. участие в р-ции анионов А. По-видимому, к.-л.
из электрохим. стадий процесса вблизи Епк замедлена,
что приводит к увеличению iпит с ростом электродного потенциала
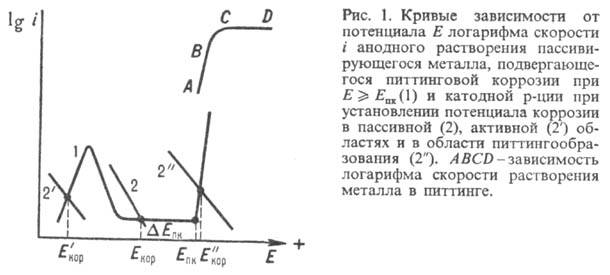
(участок AB на кривой, рис. 1); при этом обычно образуются питтинги типов
а и б (рис. 2). В области более высоких значений E (участок CD)процесс лимитируется транспортной стадией (подвод H2O или отвод
Mz+) или омич. падением потенциала и имеет сходство с электролитич.
полированием металла (образуются питтинги типа в, рис. 2).
Епк
достигается настолько высокая локальная скорость анодного растворения
в активных центрах (iпит), что она превышает скорость процесса
репассивации, поскольку ему препятствует образование при растворении металла
агрессивного кон-центрир. кислого р-ра соли M и А или солевого (оксисолево-го)
слоя, обладающего высокой катионной проводимостью. Пока при росте питтинга значения
iпит, связанные со скоростью uпит в соответствии
с законом Фарадея, остаются достаточно высокими, процесс самоподдерживается.
Важнейшую роль играет каталитич. участие в р-ции анионов А. По-видимому, к.-л.
из электрохим. стадий процесса вблизи Епк замедлена,
что приводит к увеличению iпит с ростом электродного потенциала
(участок AB на кривой, рис. 1); при этом обычно образуются питтинги типов
а и б (рис. 2). В области более высоких значений E (участок CD)процесс лимитируется транспортной стадией (подвод H2O или отвод
Mz+) или омич. падением потенциала и имеет сходство с электролитич.
полированием металла (образуются питтинги типа в, рис. 2).
Величина Епк
зависит от природы металла, т-ры, состава р-рителя, концентрации сА
и природы анионов-активаторов (см. табл.). При обычных т-рах в водных р-рах
галогенид-ионов Епк снижается примерно на 0,1 В с ростом
сА на порядок и в ряду Сl-, Br-, I-
для одних металлов возрастает (Fe, Zr, Al и др.), а для других убывает (Ti,
Nb, Та). Увеличивать Eпк и тем самым подавлять П. к.
могут мн. неорг. анионы (в условиях, когда они сами ее не вызывают) и нек-рые
орг. в-ва (ингибиторы П. к.).
При отсутствии анодной
поляризации П. к. пассивного металла развивается в условиях, когда катодный
процесс смещает его потенциал в область E Епк
(кривая 2:, потенциал
Епк
(кривая 2:, потенциал 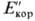 на рис. 1). В связи с этим в качестве практич. электрохим. характеристики стойкости
металла против П. к. можно использовать разность
на рис. 1). В связи с этим в качестве практич. электрохим. характеристики стойкости
металла против П. к. можно использовать разность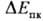 = Епк — Екор, с повышением
к-рой вероятность П. к. резко убывает. Рост
= Епк — Екор, с повышением
к-рой вероятность П. к. резко убывает. Рост 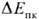 м. б. достигнут применением металлов с высокими Епк (напр.,
титана в хлоридных р-рах) или использованием этих металлов в качестве легирующих
элементов (напр., хрома в сплавах Fe-Cr и Fe-Cr-Ni); полезны гомогенизация структуры
путем рафинирования, термич., термомех. обработки, аморфизации; уменьшение cА,
введение в р-р ингибиторов П. к., воды и др. Можно также увеличить
м. б. достигнут применением металлов с высокими Епк (напр.,
титана в хлоридных р-рах) или использованием этих металлов в качестве легирующих
элементов (напр., хрома в сплавах Fe-Cr и Fe-Cr-Ni); полезны гомогенизация структуры
путем рафинирования, термич., термомех. обработки, аморфизации; уменьшение cА,
введение в р-р ингибиторов П. к., воды и др. Можно также увеличить 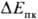 снижением Екор, напр, понижать концентрацию окислителя
в р-ре. Эффективна электрохимическая защита со смещением потенциала металла
от
снижением Екор, напр, понижать концентрацию окислителя
в р-ре. Эффективна электрохимическая защита со смещением потенциала металла
от 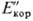 в область
E < Епк.
в область
E < Епк.
ЗНАЧЕНИЯ КРИТИЧЕСКОГО
ПОТЕНЦИАЛА ПИТТИНГООБРАЗОВАНИЯ
НЕКОТОРЫХ МЕТАЛЛОВ (0,5-1,0 M водный раствор NaCl при
20-25 0C)
|
Металл |
Епк.
В* |
||
|
Mg |
-1,42 |
||
|
Al |
~-0,5 |
||
|
Fe |
- (0,050 - 0,1) |
||
|
Ni |
0,1 - 0,15 |
||
|
Нержавеющая сталь |
0,1 - 0,25 |
||
|
Zr |
~0,4 |
||
|
Ti |
8-10 |
||
* Относительно нормального
водородного электрода.
Лит.: Колотыркин
Я.М., Попов Ю. А., Алексеев Ю. В., в сб.: Итоги науки и техники. Коррозия и
зашита от коррозии, т. 9, M., 1982; Кеше Г., Коррозия металлов, пер. с нем.,
M., 1984; Кузнецов Ю. И., "Защита металлов", 1984, т. 20, № 3, с.
359; Фрейман Л. И., в сб.: Итоги науки и техники. Коррозия и защита от коррозии,
т. 11, M., 1985; Томашов Н.Д., Чернова T. П., Теория коррозии и коррозионностойкие
конструкционные сплавы, M., 1986. Л. И. Фрейман.


