ПИННЕРА РЕАКЦИИ. 1)
Получение гидрогалогенида имидата взаимод. нитрила со спиртом и галогеноводородом
(т. наз. синтез Пиннера):
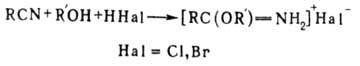
П. р. осуществляют в сухом
инертном р-рителе при т-ре 0 5 0C и эквимолярном отношении нитрила,
спирта и гало-геноводорода (обычно HCl). В р-цию вступают алифатич., ароматич.
и гетероциклич. нитрилы, а также первичные и вторичные алифатич. спирты, бензиловый
спирт и нек-рые фенолы. С целью ускорения р-ции используют избыток HCl (если
он не вызывает разложения соли имидата). Выходы составляют 70-80%.
В случае a,b-ненасыщ.
нитрилов одновременно с П. р. происходит присоединение HHaI по двойной связи.
Нитрилы, с пониж. электронной плотностью на атоме N (напр., трихлорацетонитрил)
в р-цию не вступают. Третичные спирты в условиях П. р. образуют трет-алкилгалогенид
и амид карбоновой к-ты:
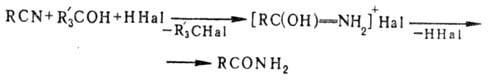
Присутствие в реакц. смеси
влаги, избытка спирта или повышение т-ры являются причиной побочных р-ций (нек-рые
из них используют в синтетич. целях):
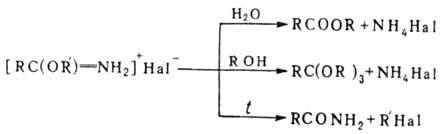
Механизм р-ции включает
промежут. образование соли имидоилгалогенида (I):
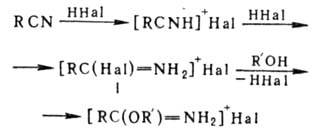
В р-цию, подобную П. р.,
вступают тиолы и тиофенолы с образованием S-алкил- и S-арилтиоимидатов.
Р-цию используют для лаб.
и пром. получения имидатов и их солей, ортоэфиров л сложных эфиров. Она открыта
А. Пиннером в 1877.
2) Получение амидинов взаимод.
гидрогалогенидов имидатов с аминами или аммиаком:
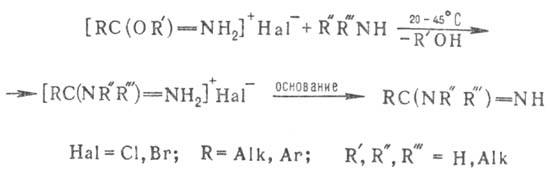
Р-цию проводят в сухом
инертном р-рителе. Ароматич. амины, обладающие слабоосновными св-вами, реагируют
с имидатами медленно и неоднозначно. Аналогично имида-там с открытой цепью реагируют
простые эфиры лактимов (циклич. имидаты):
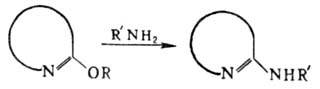
Выходы амидинов 70-85%.
В случае первичных аминов
применение его избытка или повышение т-ры р-ции приводят к обмену группы NH2
имидата:
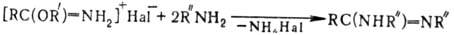
Р-цию используют для лаб.
и пром. получения амидинов, напр, ацетамидина. Она открыта А. Линкером в 1878.
Лит. Зильберман
E. H., Реакции нитрилов, M., 1972; Общая органическая химия, пер. с англ., т
3, M., 1982, с. 476 646. С. К. Смирнов.


