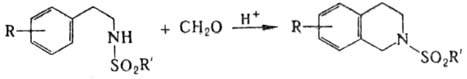
ПИКТЕ ШПЕНГЛЕРА РЕАКЦИЯ,
синтез 1,2,3,4-тетра-гидроизохинолинов конденсацией 2-арил(гетерил)этилами-нов
с альдегидами, напр.:
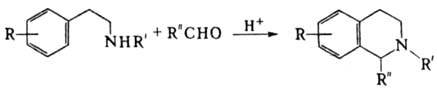
Р-цию обычно осуществляют
в водных р-рах при 100 0C, нагревая компоненты с избытком соляной
к-ты (реже используют серную, уксусную или муравьиную к-ту). В р-ции, как правило,
используют формальдегид, ацетальдегид, замещенные бензальдегиды или 2-фенилацетальдегид
(в нек-рых случаях, когда исходный альдегид неустойчив, вместо него применяют
соответствующий ацеталь или эфир енола). В качестве аминной компоненты используют
2-гетерил- или 2-фенилэтиламины, незамещенные либо содержащие в цикле алкокси-
или гидроксигруппы. Наличие алкоксигруппы облегчает циклизацию, к-рая направляется
в пара-положение к активирующей группе. Фенольный гидроксил еще сильнее
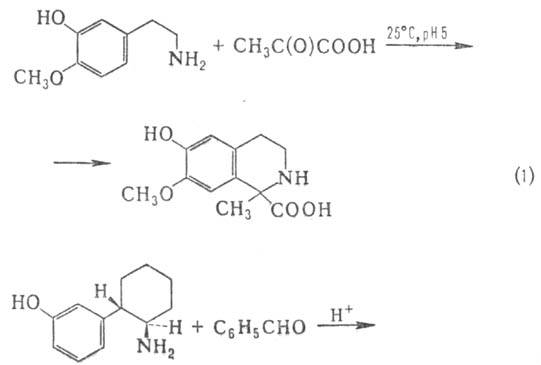
активирует бензольное кольцо, что позволяет проводить р-цию при 25-40 0C
и рН 4-8 не только с альдегидами, но и с кетонами в т. ч. с a-оксокислотами
(р-ция 1); при этом в ряде случаев циклизация осуществляется в пара-и. орто-положение
к гидроксигруппе (2):
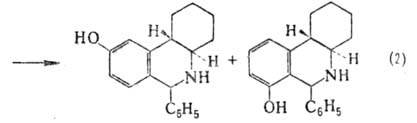
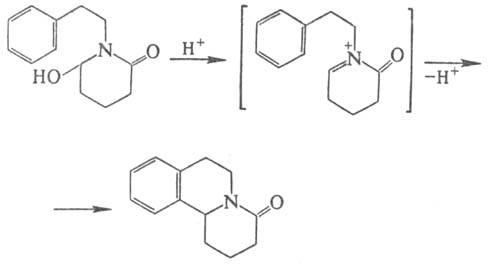
П.-Ш.р., по существу, является
внутримол. р-цией Ман-ниха и протекает по механизму электроф. замещения в ароматич.
кольце. Образующееся из фенилэтиламина и карбонильной компоненты основание Шиффа,
к-рое иногда можно выделить, циклизуется после протонирования в тстра-гидроизохинолин,
причем электронодонорные заместители облегчают р-цию:
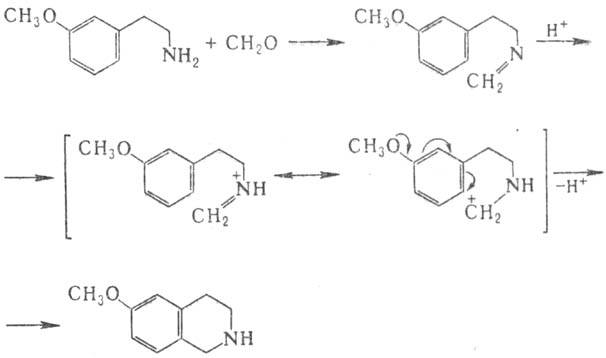
Модификация П.-Ш.р.-циклизация
N-сульфонилфенил-этиламинов в тетрагидроизохинолины в присут. кислых катализаторов:
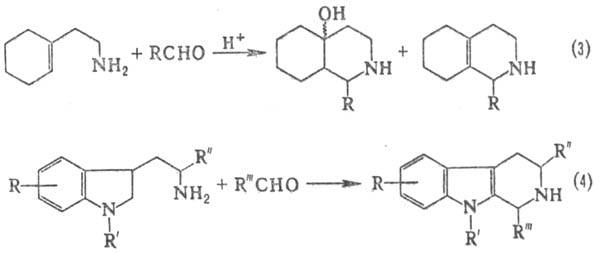
В условиях П.-Ш.р. из 1-(2-аминоэтил)циклогексена
образуется дека- и октагидроизохинолины (3), из триптамина или триптофана и
их производных-разл. тетрагидрокарбо-лины (4), многие из к-рых образуются в
мягких условиях с высоким выходом:
Сходные по механизму р-ции
осуществляются с участием N-ацилиминиевых ионов (ф-ла I), к-рые генерируются
из разл. предшественников. По сравнению с иминиевыми интермедиа-тами, образующимися
в П.-Ш.р., ацилиминиевые ионы более электрофильны, что позволяет проводить р-ции
с их участием в более мягких условиях. С помощью такого метода, родственного
П.-Ш.р., синтезированы конденсир. гетероциклы (в т.ч. нек-рые лек. ср-ва и алкалоиды),
включающие фрагмент тетрагидроизохинолина, напр.:
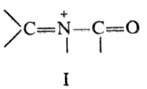
П.-Ш. р. и родственные
превращ. используют в синтезе изохинолиновых алкалоидов и др. разнообразных
азотсодержащих гетероциклич. соединений. Р-ция открыта в 1911 А. Пикте и T.
Шпенглером.
Лит.: Общая органическая
химия, пер. с англ., т. 8, M., 1985, с. 260.-61; К a m е t а n i Т.,
F u k и m о t о К., в кн.: The chemistry of heterocyclic compounds, v. 38, N.
Y., 1981, p. 139 274; Jones G., в кн.: Comprehensive heterocyclic chemistry,
v. 2. (Isoquinolines, pt. 1). Oxf., 1984, p. 438; Speckamp W. N., Hiemstra
H., "Tetrahedron", 1985, v. 41, № 20, p. 4367 -4416. Ю. С. Цизин.


