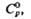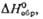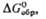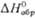ПЕРХЛОРАТЫ, соед.,
содержащие тетраэдрич. группировку ClO4. Условно различают ионные,
ковалентные и координационные П. В ионных П.-солях HClO4-группа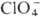 отрицательно заряжена (заряд —1). К ним относятся П. щелочных и щел.-зем. металлов,
а также мол. катионов типа
отрицательно заряжена (заряд —1). К ним относятся П. щелочных и щел.-зем. металлов,
а также мол. катионов типа 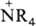 ,
,
 , [M(H2O)n]+
и др. В ковалентных П. группа ClO4 связана с остальной частью молекулы
ковалентной связью через атом кислорода (R—О—ClO3), она имеет структуру
тригональной пирамиды, ее заряд меньше 1 (по абс. величине). К ковалентным П.
относятся хлорная к-та, ее ангидрид Cl2O7 и эфиры, П.
галогенов. В большинстве П. переходных и непереходных металлов (кроме щелочных
и щел.-зем.) группа ClO4 связана с атомом металла частично ковалентной
координац. связью через один, два или три атома О, будучи соотв. моно-, би-
и тридентатным лиган-дом. Характерное св-во таких П.-способность образовывать
координационные П. анионного типа
, [M(H2O)n]+
и др. В ковалентных П. группа ClO4 связана с остальной частью молекулы
ковалентной связью через атом кислорода (R—О—ClO3), она имеет структуру
тригональной пирамиды, ее заряд меньше 1 (по абс. величине). К ковалентным П.
относятся хлорная к-та, ее ангидрид Cl2O7 и эфиры, П.
галогенов. В большинстве П. переходных и непереходных металлов (кроме щелочных
и щел.-зем.) группа ClO4 связана с атомом металла частично ковалентной
координац. связью через один, два или три атома О, будучи соотв. моно-, би-
и тридентатным лиган-дом. Характерное св-во таких П.-способность образовывать
координационные П. анионного типа 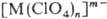 , где n= 2 — 8. Границы между группами П. нестрогие; напр., П. бора,
Si, I, большинства металлов (кроме щелочных и щел.-зем.) можно отнести и к ковалентным
и к координационным, а П. серебра, Pb, Sc и РЗЭ - и к координационным, и к ионным.
, где n= 2 — 8. Границы между группами П. нестрогие; напр., П. бора,
Si, I, большинства металлов (кроме щелочных и щел.-зем.) можно отнести и к ковалентным
и к координационным, а П. серебра, Pb, Sc и РЗЭ - и к координационным, и к ионным.
Сродство к электрону радикала
ClO4 очень высокое (5,82 эВ). Радиус иона 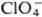 0,236 нм,
0,236 нм, 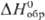 в газе -355,6 кДж/моль, а в разб. водном р-ре —129,16 кДж/моль. Распад всех
П. экзотермичен.
в газе -355,6 кДж/моль, а в разб. водном р-ре —129,16 кДж/моль. Распад всех
П. экзотермичен.
Хлорная кислота H—О—ClO3-бесцв.
летучая жидкость, сильно дымящая на воздухе, в парах мономерна; длины связей
Cl—ОН 0,1635 нм, Cl=O 0,1408 нм, О—H 0,098 нм, углы OClO 112,8°, HOClO 106,2°.
Т.пл. -101 0C, т.кип. 106 0C (с разл.); плотн. 1,7608
г/см3; ур-ние температурной зависимости давления пара lg p (мм
рт. ст.) = 8,175 — 2007/T, 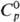 120,5 Дж/(моль·К);
120,5 Дж/(моль·К); 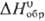 : -40,4 кДж/моль,
: -40,4 кДж/моль,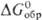 -78,5 кДж/моль;
-78,5 кДж/моль; 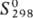 188,4 Дж/(моль·К); r 1,351·102 Ом·см; e 118 (298 К); h
0,795·10-3 Па·с. Жидкая HClO4 частично димеризована, для
нее характерна равновесная автодегидратация:
188,4 Дж/(моль·К); r 1,351·102 Ом·см; e 118 (298 К); h
0,795·10-3 Па·с. Жидкая HClO4 частично димеризована, для
нее характерна равновесная автодегидратация:
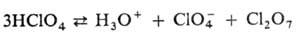
При 25 0C константа
равновесия К 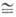 0,7·10-6.
Если пары HClO4 сконденсировать ниже 0 0C, равновесие
устанавливается в течение неск. часов. Присутствие небольшой равновесной концентрации
Cl2O7 (~0,16 M) определяет низкую термич. стабильность
жидкой HClO4; в парах, где равновесие полностью сдвинуто влево, распад
идет при 200-350 0C, в жидкой фазе-при 57-77 0C. Пар над
100%-ной HClO4 содержит 11 мол. % Cl2O7 и 89%
HClO4. Продукты термич. разложения хлорной к-ты-O2, Cl2,
ClO2, Cl2O6, HClO4
0,7·10-6.
Если пары HClO4 сконденсировать ниже 0 0C, равновесие
устанавливается в течение неск. часов. Присутствие небольшой равновесной концентрации
Cl2O7 (~0,16 M) определяет низкую термич. стабильность
жидкой HClO4; в парах, где равновесие полностью сдвинуто влево, распад
идет при 200-350 0C, в жидкой фазе-при 57-77 0C. Пар над
100%-ной HClO4 содержит 11 мол. % Cl2O7 и 89%
HClO4. Продукты термич. разложения хлорной к-ты-O2, Cl2,
ClO2, Cl2O6, HClO4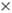 2H2O.
2H2O.
В присут. ингибиторов (CCl3COOH,
C2HCl5, CHCl3 и др.) и при разбавлении водой
термич. стабильность жидкой HClO4 повышается. Распад HClO4
в парах катализируют оксиды переходных металлов (CuO, Fe2O3,
Cr2O3 и др.).
Хлорная к-та хорошо раств.
в CF3COOH, CHCl3, CH2Cl2 и др. хлорир.
углеводородах, однако совмещение ее с р-рите-лями, способными окисляться, как
правило, приводит к воспламенению и взрыву. В безводной HClO4 раств.
ионные П.; при 0 0C р-римость (г в 100 г HClO4): KClO4
4,3, RbClO4 22,6, CsClO4 68,4. П. цезия, Rb, 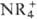 и др. крупных катионов кристаллизуются
из HClO4 в виде нестабильных комплексов M[H(ClO4)2],
легко теряющих молекулу HClO4 в вакууме.
и др. крупных катионов кристаллизуются
из HClO4 в виде нестабильных комплексов M[H(ClO4)2],
легко теряющих молекулу HClO4 в вакууме.
Известны восемь гидратов
HClO4 (табл. 1). Моногидрат 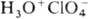 -ионный П.;
-ионный П.; 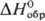 382,0 кДж/моль; в кристал-лич. структуре остальных гидратов присутствуют гидратир.
протоны
382,0 кДж/моль; в кристал-лич. структуре остальных гидратов присутствуют гидратир.
протоны 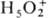 ,
,
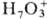 ,
, 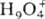 ; входящие в состав кристаллогидратов молекулы воды связаны с ионами
; входящие в состав кристаллогидратов молекулы воды связаны с ионами 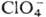 водородными связями. При -25 0C моногидрат переходит в моноклинную
модификацию (пространств. группа Р21/п). Азеотроп с
водой имеет т. кип 203 0C (0,1 МПа) и содержит 72,4% HClO4,
пар над р-рами выше этой концентрации обогащен HClO4, ниже-водой.
водородными связями. При -25 0C моногидрат переходит в моноклинную
модификацию (пространств. группа Р21/п). Азеотроп с
водой имеет т. кип 203 0C (0,1 МПа) и содержит 72,4% HClO4,
пар над р-рами выше этой концентрации обогащен HClO4, ниже-водой.
Хлорная к-та-одна из сильнейших
неорг. к-т, в ее среде соед. даже явно кислотного характера ведут себя как основания,
присоединяя протон и образуя катионы ацилпер-хлоратов, напр. 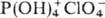 ,
, 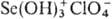 ,
, 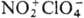 .
В безводной HClO4, а также в р-рах щелочных П. и Cl2O7
в HClO4 возможен синтез П. большинства металлов в несоль-ватир. состоянии.
.
В безводной HClO4, а также в р-рах щелочных П. и Cl2O7
в HClO4 возможен синтез П. большинства металлов в несоль-ватир. состоянии.
Конц. HClO4-сильнейший
окислитель, контакт ее с большинством орг. материалов приводит к воспламенению
и взрыву. Окислит. активность к-ты с концентрацией менее 72% значительно ниже,
а термич. устойчивость - выше, чем у 95-100%-ной HClO4.
Водные р-ры HClO4
получают анодным окислением р-ра соляной к-ты или Cl2, р-р, близкий
по составу к дигидра-ту, - ректификацией более разб. р-ров, 100%-ную HClO4-отгонкой
из смеси HClO4·2H2O с олеумом. Водные р-ры HClO4
применяют в аналит. химии для растворения металлов, "влажного сожжения"
орг. в-в и как стандарт в ациди-метрии; как компонент полировальных ванн для
металлов.
Ионные П. П. щелочных и
щел.-зем. металлов -бесцв. кристаллы (табл. 2). П. всех щелочных металлов, кроме
Li, диморфны; при обычных условиях устойчива ромбич. модификация, при высоких
т-рах - кубическая. Перхлорат Sr также диморфен, перхлораты Ca и Ba имеют по
три модификации. Все П., кроме солей К, Rb и Cs, гигроскопичны и образуют гидраты,
напр. Са(СlО4)2·4H2O (т.пл. 75,6 0C),
Sr(ClO4)2·H2O (т.пл. 155 0C).
Табл. 1.- НЕКОТОРЫЕ
СВОЙСТВА HClO4 ·nН2О
|
n |
Сингония |
Пространств. группа |
Т.пл., 0C |
||
|
0.25 |
— |
— |
-73,0* |
||
|
1 |
Ромбич. |
Pnma |
49,90 |
||
|
2 |
Ромбич. |
Pnma |
-20,6 |
||
|
2,5 |
Моноклинная |
P21/c |
-32,1 |
||
|
3 |
Ромбич. |
Pbca |
-40,20 |
||
|
3,5 |
Ромбич. |
Pbca |
-45,60 |
||
|
4 |
— |
— |
-57,7* |
||
|
5,5 |
Кубич. |
— |
-50,4 |
||
* Инконгруэнтно.
Табл. 2.-СВОЙСТВА ПЕРХЛОРАТОВ
ЩЕЛОЧНЫХ И ЩЕЛОЧНОЗЕМЕЛЬНЫХ МЕТАЛЛОВ
|
Перхлорат |
Пространств. группа
низкотемпературной модификации |
Т-ра поли-морфного
перехода, 0C |
Т.пл., 0C |
Т-ра начала быстрого
разложения, 0C |
Плотн., г/см3 |
Дж/(моль·К) |
кДж/моль |
кДж/моль |
Р-римость в воде
при 25 0C, г в 100 г |
||
|
LiClO4 |
— |
— |
247,6 |
438 |
2,432 |
104,7 |
-380,87 |
-252,3 |
37,38 |
||
|
NaClO4 |
Cmcm |
306,1 |
469* |
525 |
2,495 |
110,3 |
-384,42 |
-255,5 |
67,70 |
||
|
KClO4 |
Pnma |
298,0 |
580* |
580 |
2,536 |
108,0 |
-432,42 |
-303,5 |
2,02 |
||
|
RbClO4 |
Pnma |
281,1 |
597* |
597 |
3,035 |
109,4 |
-436,73 |
-306,5 |
1,32 |
||
|
CsClO1 |
Pnma |
221,8 |
577* |
577 |
3,319 |
110,4 |
-442,62 |
-310,6 |
1,93 |
||
|
Ca(ClOJ2 |
— |
340,8 410 |
— |
477 |
2,651 |
185,3 |
-735,76 |
-412,3 |
65,35 |
||
|
Sr(ClO4)2 |
— |
288 |
— |
472 |
2,947 |
187,8 |
-768,48 |
-514,8 |
75,59 |
||
|
Ba(ClO4)2 |
— |
284 350 |
— |
477 |
3,574 |
185,8 |
-785,29 |
-526,0 |
66,48 |
||
* С разложением.
Табл. 3.-СВОЙСТВА ОНИЕВЫХ
ПЕРХЛОРАТОВ
|
Перхлорат |
Сингония |
Пространств. группа |
Т.пл., 0C |
Т-ра медленного
разложения, |
Плотн., г/см3 |
кДж/моль |
||
|
N2H5ClO4 |
Моноклинная |
C2/c |
142 |
140-190 |
1,939 |
-173,8 |
||
|
NH3OHClO4 |
Ромбич. |
P21сn |
89 |
110-150 |
2,065 |
-281,6 |
||
|
C(NH2)3ClO4 |
Тригон. |
R3 |
248 |
275-400 |
1,743 |
-311,7 |
||
|
C(NH2)2NHNO2ClO4 |
— |
— |
Разлага-ется |
100-120 |
1,932 |
-211,5 |
||
|
NOClO4 |
Ромбич. |
Рпта |
То же |
100-140 |
2,169 |
52,3 |
||
|
NO2ClO4 |
Моноклинная |
C2/c |
— " — |
100-150 |
2,220 |
39,0 |
||
|
(CH3)2N
(NH2)2ClO4 |
— |
— |
— " — |
120-140 |
1,56 |
-69,7 |
||
Ионные П. почти количественно
разлагаются при нагревании до хлорида металла и O2 с промежут. образованием
хлората. В присут. SiO2 и др. термически устойчивых кислотных оксидов
в продуктах распада появляется Cl2. Оксиды переходных металлов, особенно
Ni, Со и Mn, снижают т-ру разложения П. Еще более понижают т-ру разложения ионных
П. оксиды или пероксиды щелочных металлов. П. хорошо раств. в воде и полярных
орг. и неорг. р-рите-лях-спиртах, ацетоне, гидразине, H2O2-
и образуют с ними сольваты. Конц. р-ры П. в окисляемых жидкостях взрывоопасны.
В жидком состоянии П. щелочных и щел.-зем. металлов неограниченно раств. друг
в друге, образуя эвтектики; т-ры плавления эвтектик: 205 0C NaClO4—LiClO4
(71,5 мол. %); 207 0C KClO4—LiClO4 (76,0%);
234 0C Ca(ClO4)2— LiClO4 (76,9%);
293 0C Ca(ClO4)2—NaClO4 (44,9%).
Ион 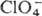 устойчив к действию большинства восстановителей в водном р-ре, количественно
восстанавливается до
устойчив к действию большинства восстановителей в водном р-ре, количественно
восстанавливается до 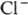 только под действием солей Ti(III), Mo(III) и V(III) в кислой среде. П. металлов
II гр. и нек-рые другие выше 200 0C реагируют с пероксидами и супероксидами
щелочных металлов:
только под действием солей Ti(III), Mo(III) и V(III) в кислой среде. П. металлов
II гр. и нек-рые другие выше 200 0C реагируют с пероксидами и супероксидами
щелочных металлов:
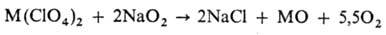
Р-ция может протекать в
режиме самораспространения.
П. получают анодным окислением
хлоратов или хлоридов металлов в водном р-ре или р-цией водной HClO4
с карбонатом или оксидом соответствующего металла. П. легких щелочных и щел.-зем.
металлов отличаются высоким содержанием кислорода: LiClO4-60,15%,
NaClO4-52,27%, КСlO4-46,19%, Ca(ClO4)2-53,35%.
Объемное содержание кислорода в П. соизмеримо с его содержанием в жидком и твердом
кислороде. На этом основано применение П. в качестве высокоемких твердых кислородоносителей
в хим. источниках кислорода (см. Пиротехнические источники газов), в
смесевых BB и в пиротехн. составах.
ОниевыеП.  . Хлорная к-та способна присоединяться к любым орг. и неорг. соед., имеющим
сродство к протону, с образованием ониевых катионов: R +
HClO4
. Хлорная к-та способна присоединяться к любым орг. и неорг. соед., имеющим
сродство к протону, с образованием ониевых катионов: R +
HClO4 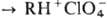 . Известно неск. сотен таких соед., наиб. изучены П., где RH+-NH
. Известно неск. сотен таких соед., наиб. изучены П., где RH+-NH