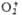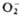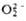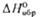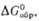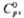ПЕРОКСИДНЫЕ
СОЕДИНЕНИЯ НЕОРГАНИЧЕСКИЕ, содержат группировку из связанных между собой
двух атомов О. Употребляют
также назв. дикислородные соединения. Общее св-во большинства пероксидных соед.
(П.с.)-способность сравнительно легко выделять кислород (при нагр., при действии
воды или др. в-в), поэтому иногда говорят, что кислород в них присутствует в
активной форме и наз. его активным кислородом.
Различают ионные и ковалентныеП.с.
Дикислород-ная группировка может существовать в трех ионных формах, поэтому
ионные П. с. подразделяют на три осн. группы: пероксиды с ионом 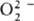 ; супероксиды (гипероксиды) с ионом
; супероксиды (гипероксиды) с ионом 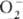 ; диоксигенильные соединения с ионом
; диоксигенильные соединения с ионом 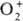 . К ионным П. с. относят также озониды неорганические, гидропе-роксиды
и соли пероксония, содержащие соотв. ионы
. К ионным П. с. относят также озониды неорганические, гидропе-роксиды
и соли пероксония, содержащие соотв. ионы 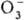 ,
, 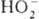 ,
, 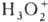 .
Среди ионных П. с. только пероксиды диамагнитны и не окрашены (или их окраска
не связана с пероксид-ной группой), остальные парамагнитны и, как правило, ярко
окрашены.
.
Среди ионных П. с. только пероксиды диамагнитны и не окрашены (или их окраска
не связана с пероксид-ной группой), остальные парамагнитны и, как правило, ярко
окрашены.
Ковалентные П. с. имеют
общую ф-лу R—О—О—R', где R и R' - неорг. радикалы или атомы. К этой группе относят
водорода пероксид, пероксокислоты, пероксосольваты, хлор-перокситрифторметан
CF3OOCl, соед. с цепочкой из трех атомов О, напр. CF3OOOCF3,
и др. Ионы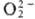 и
и 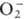 могут
образовывать координац. связи с ионами переходных и непереходных элементов,
соответствующие соед. входят в группу комплексных П. с., близких по св-вам к
ковалентным П. с. Диоксидифторид О2F2, соед. с цепочкой
из трех атомов О (напр., CF3OOOCF3) и нек-рые другие также
можно отнести к П. с. К комплексным П. с. следует отнести соед., обратимо отдающие
кислород,-комплексы с мол. кислородом, важнейший из к-рых-оксигемоглобин. Энергия,
длина и порядок связи О—О в молекуде П.с, зависят от заряда на группе O2
(табл. 1).
могут
образовывать координац. связи с ионами переходных и непереходных элементов,
соответствующие соед. входят в группу комплексных П. с., близких по св-вам к
ковалентным П. с. Диоксидифторид О2F2, соед. с цепочкой
из трех атомов О (напр., CF3OOOCF3) и нек-рые другие также
можно отнести к П. с. К комплексным П. с. следует отнести соед., обратимо отдающие
кислород,-комплексы с мол. кислородом, важнейший из к-рых-оксигемоглобин. Энергия,
длина и порядок связи О—О в молекуде П.с, зависят от заряда на группе O2
(табл. 1).
Табл. 1. ХАРАКТЕРИСТИКА
СВЯЗИ О—О
|
Показатель |
|
O2 |
|
|
||
|
Энергия связи,
кДж/моль |
642 |
494 |
~390 |
~200 |
||
|
Длина связи. нм |
0.112 |
0,121 |
0,128 |
-0,15 |
||
|
Порядок связи |
2,5 |
2 |
1,5 |
I |
||
Примеры П.с.-ионные пероксиды
и гидропероксиды Na2O2, BaO2, NH4OOH;
координац. пероксиды и гидропероксиды [Nb(O2)] 3—, [Ti(O2)F5]
3—, [BF3OOH]—; пероксокислоты и их соли H2CO4,
KHSO5; пероксосольваты Na2CO3·1,5H2O2,
СО(NH2)2·H2O2; соли пероксония H3O2+AsF6—,
H3O2+SbF6— ; ионные супероксиды
NaO2, KO2, Са(О2)2; координац. супероксиды
[Co(O2)(CN)5]3—, [{Co(NH3)5}2(O2)]5+
; озониды KO3, RbO3, CsO3; комплексы с мол.
кислородом-соед. ф-лы А ("салькомин"); соли диоксигенила
O2BF4, O2PtF6.
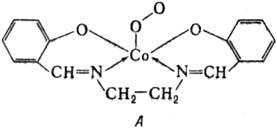
Пероксиды. Пероксиды щелочных
металлов М2О2-бесцв. кристаллы, решетка к-рых построена
из ионов O22— и M+ (табл. 2). В водном р-ре
полностью гидролизуют-ся до MOH и H2O2, в случае П. с.
Li и Na гидролиз в значит. степени обратим; из водно-пероксидного р-ра кристаллизуются
пероксосольваты, напр. Li2O2·2H2O2,
Na2O2·2H2O2·4H2O.
Известны также K2O2·nH2O2
(n= 2,4). Состав сольватов определяется т-рой и концентрацией H2O2
и щелочи в р-ре. M2O2 реагируют с парами воды и
с CO2, выделяя O2 и образуя MOH и M2CO,- Активность
M2O2 в этой р-ции растет от Li2O2
к Cs2O2. На этой р-ции основано применение Li2O2
и Na2O2 в качестве компонентов регенеративных в-в в дыхат.
аппаратах изолирующего типа. M2O2-довольно активные окислители,
мн. орг. в-ва (спирты, эфиры и др.) воспламеняются в контакте с ними.
Taбл. 2.-СВОЙСТВА ПЕРОКСИДОВ
МЕТАЛЛОВ
|
Соединение |
Сингония (пространств.
группа) |
Рентгеновская плотн., г/см3 |
кДж/моль |
кДж/моль |
Дж/(моль·К) |
||
|
Li202 |
Гексагон. (Р6) |
2,36 |
-634 |
-573 |
74,9 |
||
|
Na2O2 |
Гексагон. (P62) |
2,61 |
-510 |
-449 |
89,3 |
||
|
K2O2 |
Ромбич. (Стса) |
2,39 |
-496 |
-379 |
90,8 |
||
|
Rb2O2 |
Ромбич. (Immm) |
3,79 |
-450 |
-392 |
92,9 |
||
|
Cs2O2 |
Ромбич. (Immm) |
4,80 |
-450 |
-394 |
95,0 |
||
|
MgO2 |
Кубич. (Ра3) |
3,29 |
-550 |
- |
- |
||
|
CaO2 |
Тетрагон. (I4/ттт) |
3,18 |
-662 |
- |
- |
||
|
SrO2 |
Тетрагон. (I4/ттт) |
4,71 |
-637 |
- |
|
||
|
BaO2 |
Тетрагон. (I4/ттт) |
5,64 |
-623 |
- |
|
||
|
ZnO2 |
Кубич. (Ра3) |
5,60 |
-350 |
- |
|
||
|
CdO2 |
Кубич. (Ра3) |
6,36 |
-250 |
- |
- |
||
Пром. способом производят
только натрия пероксид и немного Li2O2(Hs LiOH
и H2O2 в воде с послед. сушкой сольвата).
Пероксиды элементов II
группы MO2 образуют все щел.-зем. металлы. Бесцв. кристаллы, малогигроскопичны.
Т-ра распада MO2 растет от Mg к Ba, причем в случае соед. Ba и Sr
р-ция MO2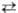 МО
+ l/2O2 обратима; давление диссоциации p
МО
+ l/2O2 обратима; давление диссоциации p
Сетевое издание "Здоровый дух" серия Эл № ФС77-86198 от 27 октября 2023 г., выдано Федеральной службой по надзору в сфере связи, информационных технологий и массовых коммуникаций.
Учредитель и главный редактор В.В. Горшенин
Телефон: +7 (499) 641-41-69
Адрес, e-mail редакции, 105066, Россия, Москва, ул. Старая Басманная, д.16/1Б, info@pora.ru