ПЕРОКСИДАЗЫ (донор:
пероксид водорода оксидоредук-тазы), ферменты класса оксидоредуктаз, катализирующие
окисление с помощью H2O2 разл. неорг. и орг. в-в по схеме:
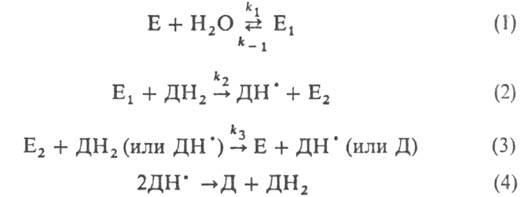
E, E1 и E2-
соотв. исходная П. и ее окисленные формы; ДН2, ДН• и Д-соотв.
исходный, полуокисленный и окисленный субстраты; k-константа скорости
р-ции.
Р-ция 1 практически необратима
(k1/k_1 > 108). Наиб. медленная
стадия - р-ция 3. П. высокоспецифичны к H2O2 и обычно
обладают широкой специфичностью к субстрату (известны П., проявляющие высокую
специфичность).
Наиб. изучена П. из корней
хрена (мол. м. 40 тыс.), молекула к-рой состоит из одной полипептидной цепи
(308 аминокислотных остатков), связанной ковалентно с 8 олиго-сахаридными цепями.
Молекула содержит также некова-лентно связанный гем с атомом Fe(III) у E и Fe(IV)
у E1 и E2 (у нек-рых П. гем отсутствует). При рН ниже
3 и выше 12 гем-белковый комплекс разрушается.
П. существует в виде неск.
форм (изоферментов), состав и соотношение между к-рыми зависит от состояния
растения. Для наиб. распространенного изофермента из хрена (П. С) определена
аминокислотная последовательность, на основании к-рой синтезирован ген П. Для
П. из этого источника установлена корреляция между окислит.-восстановит, потенциалом
субстрата и величиной k2 . Наиб. активные субстраты
— п- и о-замещенные фенолы и ароматич. амины, для к-рых fc3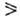 104M-1 с-1.
104M-1 с-1.
Оптим. каталитич. активность
П. из разных источников в р-циях с орг. субстратами при рН 5-7, с неорганическими
при рН 4. Ингибиторы П.-ионы, образующие прочные комплексы с катионом Fe(CN—,
N3—, S2— и др.).
П. широко распространены
в животных и растит. клетках (могут находиться как в связанном с клеточной стенкой
состоянии, так и в цитоплазме); они участвуют в фотосинтезе, энергетич. обмене,
в трансформации пероксидов и в-в, чужеродных организму. Активность П. и изоферментный
состав значительно изменяются при стрессовых состояниях, ранении, вирусном или
микробном инфицировании организма.
Используют П. в аналит.
целях (напр., для определения микроколичеств H2O2, ароматич.
аминов, загрязнений в окружающей среде), а также в иммуноферментном анализе.
Данные по пероксидазной активности учитывают при селекции растений (чем выше
эта активность, тем устойчивее к инфекции растения). Перспективно применение
П. для селективного окисления орг. соединении, а также для глубокой очистки
сточных вод от ароматич. соединений.
Лит.: Неорганическая биохимия,
пер. с англ., т. 2. M., 1978, с. 434-68; Угарова H. H., Лебедева О. В., "Биохимия",
1978, т. 43, в. 10, с. 1731-40; Андреева В. А., Фермент пероксидаза, M., 1988.
H. H. Угарова.


