ПЕПТИДНЫЕ АНТИБИОТИКИ,
антимикробные соед , в молекулах к-рых имеются пептидные связи. В хим. отношении
это весьма разнородная группа в-в, большинство из к-рых-циклич. или линейные
олиго- и полипептиды, содержащие заместители непептидной природы (остатки жирных
к-т, алифатич. аминов и спиртов, гидроксикислот, а также Сахаров и гетероциклов).
Различают пять осн. видов
П. а.: 1) производные аминокислот (напр., циклосерин, b-лактамные антибиотики)и дикетопиперазина (глиотоксин, ф-ла I); 2) гомомерные пеп-тиды-линейные
(грамицидин А, II) и циклические [бацит-рацин А, III (здесь и ниже буквы греч.
алфавита показывают положение аминогрупп, к-рые участвуют в образовании связей);
виомицин,, IV; капреомицин 1-А, V], а также олиго-пептиды (нетропсин, VI; дистамицин,
VII); 3) гетеромерные пептиды [напр., полимиксины В, E и M, ф-лы соотв. VIII,
IX и X; R = 6-метилоктаноил (B1, E1 и M1) или
изооктаноил (B2, E2 и M2); Dab -2,4-диаминомасляная
к-та], в т.ч. хелато-образующие (блеомицины); 4) пептолиды-хромопептолиды
(актиномицины), липопептолиды (стендомицин, XI; здесь и ниже буквы Me
перед лат. обозначениями аминокислот, кроме Pro, указывают на наличие в них
метильной группы у атома N; МеРго 4-метилпролин), гетеропептолиды (мика-мицин
В, XII; стафиломицин S, XIII), простые пептолиды (гризелимицин A, XIV) и депсипептиды
(валиномицин; см. Ионофоры); 5) макромолекулярные пептиды полипептиды
(низин, XV; сульфидные мостики связывают b-С-атомы Ala и Abu), белки (неокарциноста-тин,
содержащий 109 аминокислотных остатков), протеиды (аспарагиназа, лизостафнин
с мол. м. 32000).
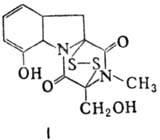
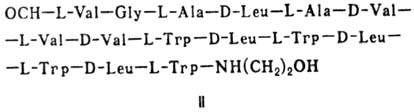
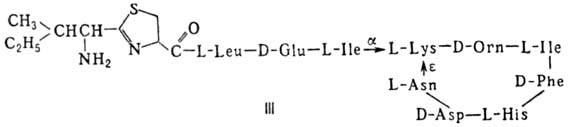
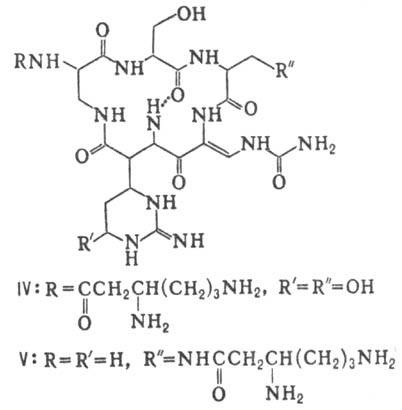
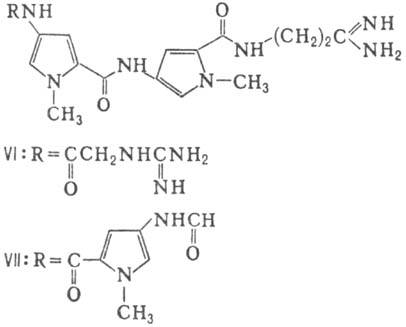
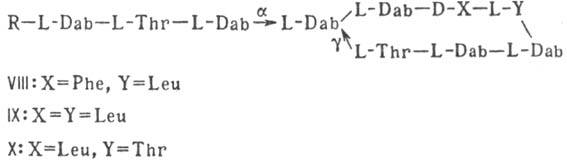
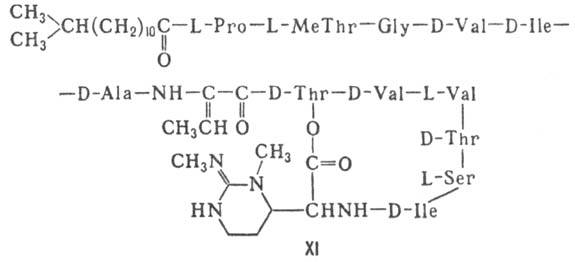
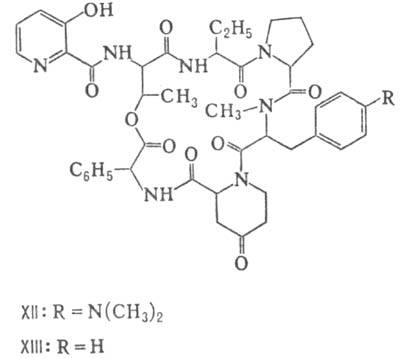
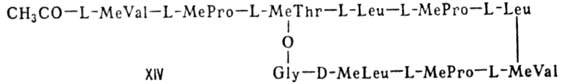
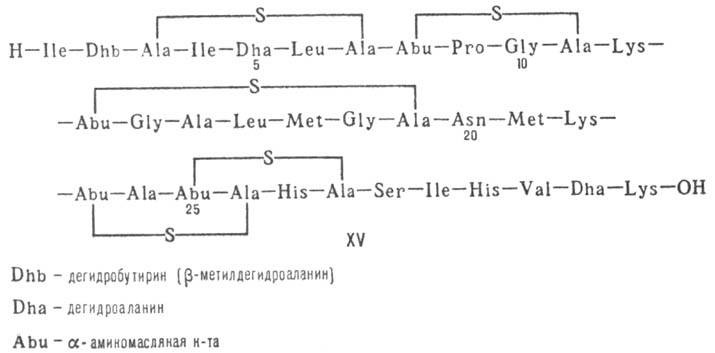
Гомо- и гетеромерные пептиды,
пептолиды имеют ряд характерных особенностей, к-рые отличают их от обычных полипептидов
и белков: а) низкое содержание нек-рых простых аминокислот (аргинин, гистидин,
метионин), наличие аминокислот D-конфигурации и аминокислот необычной структуры
(серосодержа-щих, сложных гетероциклич., ненасыщенных, N-метилированных, имино-,
b- и g-аминокис-лот, производных пролина); б) наличие в составе молекул
заместителей непептидной природы; в) преим. циклич. или линейно-циклич. структура
без своб. карбокси- и аминогрупп; циклизация между собств. аминокислотными радикалами
с образованием тиазолинов, окса-золинов и др. гетероциклич. структур. Кроме
того, П. а., как правило, устойчивы к действию гидролаз, хотя нек-рые из них
(полимиксины, блеомицины) чувствительны к аминоацилазам и пептидазам микробного
и растит. происхождения.
П. а. продуцируются в виде
смеси родственных соед., отличающихся друг от друга одним или неск. аминокислотными
остатками или вариациями в строении компонентов непептидной природы. Продуцентами
являются разл. виды актиномицетов, бактерий и грибов. Биосинтез пептидов и депсипептидов
осуществляется без участия рибосом и РНК с помощью специфич. ферментных комплексов-синтетаз
антибиотиков, содержащих всю необходимую информацию. Для ряда П. а. выяснен
мол. механизм биосинтеза или установлен состав синтетаз. В процессе полимеризации
или после образования пептидной цепи происходит циклизация молекулы и модификация
отдельных аминокислот. Биосинтез макромолекулярных П. а. (в частности, низина)
происходит на рибосомах с послед. модификацией белка-предшественника.
П. а. имеют разнообразные
биол. св-ва. Среди.них встречаются ингибиторы синтеза клеточной стенки (бацитрацин
А) и синтеза липопротеидов наружной мембраны грамотри-цат, бактерий (бицикломицин),
ингибиторы репликации и транскрипции (актиномицин D, блеомицины) и синтеза белка
(виомицин), ингибиторы функционирования клеточной мембраны (полимиксины, грамицидин,
валиномицин), антиметаболиты (аланозин, циклосерин). П. а. обладают высокой
антибиотич. активностью в отношении грамполо-жит. (бацитрацин А) и грамотрицат.
(полимиксины) бактерий, а также микобактерий (капреомицин 1-А, виомицин). Ряд
антибиотиков проявляют противоопухолевую (актино-мицины, аспарагиназа) и противогрибковую
активность; дистамицин весьма активен в отношении вирусов.
П. а. широко применяют
в ветеринарии (микамицин В, нетропсин), в качестве кормовых добавок (бацитрацин
А, стафиломицины), как консерванты (низин), в биохим. исследованиях (валиномицин,
грамицидины, актиномицины). Использование П.. а. в терапии довольно ограниченно
из-за нежелат. побочных эффектов, в частности нефроток-сичности. Широко применяют
лишь полимиксины В, E и M, нек-рые противоопухолевые (блеомицин A2,
актиномицин D, аспарагиназа) и противотуберкулезные препараты (циклосерин, виомицин,
капреомицин 1-А, лизостафнин). П. а., однако, вытесняются из мед. практики менее
токсичными антибиотиками.
Лит. Ланчини Д..
Паренти Ф., Антибиотики, пер. с англ., M., 1985; Антибиотики-полипептиды (структура,
функция, биосинтез), под ред. H. С. Егорова, M., 1987; Bioactive peptides produced
by microorganisms, ed. by H. Umezawa, T. Takita, T. Shiba, Kodansha, Tokyo,
1978; Berdy J., CRC Handbook of antibiotic compounds, v. 4, pt 1 2, Boca Raton,
1980. А. А. Зинчепко.


