ПАССИВНОСТЬ МЕТАЛЛОВ,
повышенная стойкость металлов против коррозии в условиях, когда термодинамически
металл реакционноспособен. Обусловлена образованием защитных поверхностных соединений
при взаимодействии металла с компонентами среды в процессе анодного растворения.
Переход металла в пассивное состояние наз. пассивацией, образующийся на
его пов-сти слой-пассивирующим слоем. Пассивирующие слои тормозят, помимо окисления
металлов, также протекание на их пов-сти электродных окислит.-восстановит. р-ций.
По составу пассивирующих слоев различают оксидную П. м. и солевую (возможны
слои более сложного состава). Термин "П. м." нередко используют
для описания торможения поверхностными слоями нек-рых др. гетерог. р-ций: газовой
коррозии (оксидные пленки и окалины), электрокристаллизации (адсорбц. пленки
ПАВ).
П.м. была открыта М.В.Ломоносовым
(1743) на примере устойчивости железа к растворению в концентрир. HNO3;
более подробно эта система была исследована M. Фарадеем (1836), к-рый пришел
к выводу об образовании на границе металл-к-та особого защитного слоя. Впоследствии
выяснилось, что пассивность характерна для переходных и ряда др. металлов в
первую очередь в водных и многих водно-орг. р-рах электролитов, где пассивирующим
компонентом является вода.
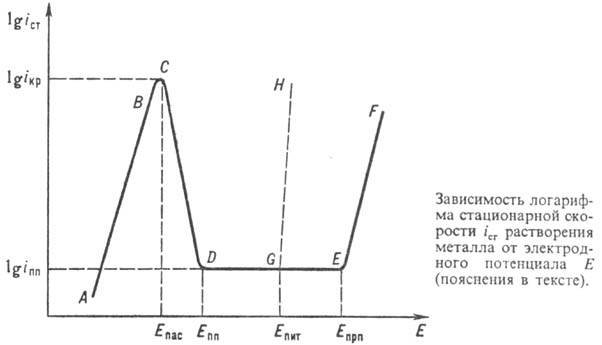
Основные закономерности
П.м. установлены посредством изучения зависимости от электродного потенциала
E стационарной скорости iст растворения металла M (см.
рис.). При изменении E путем анодной поляризации или введения в р-р окислителя
(молекул O2, ионов Fe3+, Ce4+ и др.) наблюдается
характерный для активного металла экспо-ненц. рост iст с повышением
E (участок AB). Затем рост iст замедляется и
выше нек-рого потенциала Епас скорость растворения
металла резко снижается (участок CD)и принимает практически постоянное
(обычно низкое) значение в интервале потенциалов Епп -
Епрп(участок DE-пассивная область), после чего рост скорости
растворения возобновляется (участок EF). Значение Eпас
обычно наз. потенциалом пассивации, соответствующую ему скорость растворения
металла iкр-критич. током пассивации , Еппи
iпп - потенциалом и током полной пассивации (полной пассивности).
Потенциал Eпрп, при к-ром растворение вновь ускоряется, наз.
потенциалом перепассивации (EF- область перепассивации).
Описанные характерные потенциалы
и токи (пассивацион-ные характеристики) определяются составами и св-вами металла
и среды (см. табл.). В общем случае эти характеристики улучшаются с повышением
сродства металла к кислороду, при гомогенизации структуры металлич. материала,
в частности аморфизацией или созданием микрокристаллич. структуры.
Значения Enac,
iкр и Еппобычно снижаются при уменьшении т-ры
среды, повышении рН (от кислых до нейтральных или слабощелочных р-ров), увеличении
концентрации воды 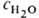 в водно-орг. р-рах электролитов. При
в водно-орг. р-рах электролитов. При 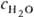 ниже нек-рого критич. значения (
ниже нек-рого критич. значения (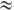 0,01-10%)
оксидная П.м.
0,01-10%)
оксидная П.м.
ХАРАКТЕРИСТИКИ ПАССИВНОСТИ
НЕК-РЫХ МЕТАЛЛОВ В ДЕАРИРОВАННЫХ
0,5-1 M P-PAX H2SO4 при 20 25 oС (потенциалы
Eпас, Епп и
Епрп в В по отношению к нормальному водородному электроду, токи iкр
и iпп-
в А/м2) становится невозможной: вместо снижения iкр
регистрируется выход на предельный анодный ток. Подобным же образом кривая E-iст
трансформируется при увеличении концентрации HCl в водном р-ре, т-ры и т.п.
Возможен самопроизвольный (без поляризации от внеш. источника) переход металла
в пассивное состояние-самопассива-ц и я. Она происходит, если скорость катодного
восстановления окислителя iок при Епас
удовлетворяет соотношению: iок > iкр.
При этом потенциал коррозии Eкор устанавливается в пассивной
области выше Еппи отсутствует максимум на зависимости анодного
тока от потенциала (см. Коррозия металлов).
|
Металл |
Eпас |
iкр |
Епп |
iпп |
Eпрп |
||
|
Железо |
|
2·103 |
|
7·10-2 |
1,65 |
||
|
Никель |
0,15 |
1·102 |
0,4 |
2,5·10-2 |
1,1 |
||
|
Хром |
-0,35 |
1,7·102 |
-0,05 |
5·10-4 |
1,1 |
||
|
Молибден |
|
- |
<-0,3 |
1·10-4 |
0,1 |
||
|
Титан |
-0,25 |
0,6 |
0,0 |
1·10-2 |
- |
||
|
Нержавеющая сталь
18Cr -8Ni |
-0,05 |
1,0 |
0,1 |
1·10-3 |
1,1 |
||
|
Аморфный сплав
Fe70Cr10P13C7 |
0,0 |
1,0 |
0,3 |
1,5·10-2 |
1,05 |
||
При наличии в р-ре определенных активирующих анионов (Cl- , Br-, CNS- и др.) при нек-ром потенциале Eпит < Eпрпна участке GH может развиваться др. процесс нарушения П.м.-локальная активация (см. Питтинговая коррозия). В области потенциалов положительнее Eпрп растворение металла обусловлено развитием нового анодного процесса, гл. обр. окисления металла до его соед. высшей валентности, не обладающих защитными св-вами (напр., CrVI вместо CrIII). В пассивной области при быстрых изменениях потенциала наблюдаются отклонения тока i от стационарного значения. В частности, при скачкообразном повышении E ток вначале резко увеличивается, в первом приближении по ур-нию:
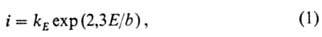
где kE
- предэкспоненц. множитель, зависящий от потенциала и времени, b-эмпирич.
постоянная. Затем ток возвращается (с замедлением) к значению iст.
При этом в кислых р-рах разность i — iст расходуется
частично на переход ионов металла в р-р, частично на дополнит. формирование
пассивирующего слоя (в первые мгновения, вероятно, и на его депротонизацию,
т. к. обычно этот слой в той или иной мере гидратирован).
Механизм оксидной П.
м. Относительно природы пассиви-рующих оксидных слоев и механизма торможения
ими растворения металла традиционно существуют две точки зрения. Согласно "пленочной"
концепции, пассивный металл защищен от коррозии сплошной (беспористой) поверхностной
пленкой фазового оксида. Действительно, в большинстве случаев на пов-сти пассивных
металлов разл. методами обнаружены и изучены фазовые оксиды толщиной обычно
до неск. нм. В зависимости от природы металла и условий пассивации такие пленки
по строению и св-вам различаются: они бывают одно- и двухслойными, кристал-лич.,
аморфными, полимерного типа, полупроводниковыми n-типа, р-типа
или со св-вами p-n-перехода. Во всех случаях для барьерного слоя
пленки, лимитирующего транспорт реагентов, характерна небольшая нестехиометричность,
в частности избыток кислорода или недостаток катионных вакансий на внешней (обращенной
к электролиту) стороне слоя. Значения Eпас и Еппдля
ряда металлов (Fe в щелочных р-рах, Ni, Cu и др.) весьма близки к равновесным
потенциалам металл-оксидных электродов типа M
+ nH2O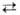 MOn
+ 2nH+ + 2nе. Законы утолщения оксидных пленок
во времени (логарифмич., параболич. и др.) аналогичны таковым при росте оксидных
слоев и окалин в процессах газовой
коррозии, а электрохим. процессы на нек-рых оксидных электродах подобны таковым
на пассивных металлах. "Адсорбционная" концепция исходит из представлений
об энергетич. неоднородности пов-сти металла; предполагается, что П. м. может
обеспечиваться долями монослоя кислорода, к-рый образуется при диссоциативной
хемосорб-ции воды на металле. Хемосорбированный кислород изменяет строение двойного
электрического слоя или блокирует активные центры на пов-сти, образуя прочные
хим. связи с металлом (частично ковалентного типа). Пассивация долями монослоя
экспериментально подтверждена для ряда систем, напр. Fe в щелочных р-рах, Pt
и Ni в кислых. К тому же пассивирующие оксидные слои в нек-рых случаях настолько
тонки, что их трудно считать фазовыми (Cr в к-тах). В пользу адсорбц. концепции
свидетельствует тот факт, что, напр., Ni ведет себя как пассивный металл в серной
к-те с добавлением ионов I- или в диметилсульфоксидных р-рах в условиях,
когда на его пов-сти образуются адсорбц. слой ионов I- или молекул
диметилсульфоксида (фазовые оксидные пленки отсутствуют). Кривая анодного растворения
в области перехода к пассивному состоянию (участок ABCD на рис.) м. б.
рассчитана на основе представлений о конкуренции анодного растворения (р-ции
2,3) и пассивирующей адсорбции кислорода (р-ции 2, 4, 5):
MOn
+ 2nH+ + 2nе. Законы утолщения оксидных пленок
во времени (логарифмич., параболич. и др.) аналогичны таковым при росте оксидных
слоев и окалин в процессах газовой
коррозии, а электрохим. процессы на нек-рых оксидных электродах подобны таковым
на пассивных металлах. "Адсорбционная" концепция исходит из представлений
об энергетич. неоднородности пов-сти металла; предполагается, что П. м. может
обеспечиваться долями монослоя кислорода, к-рый образуется при диссоциативной
хемосорб-ции воды на металле. Хемосорбированный кислород изменяет строение двойного
электрического слоя или блокирует активные центры на пов-сти, образуя прочные
хим. связи с металлом (частично ковалентного типа). Пассивация долями монослоя
экспериментально подтверждена для ряда систем, напр. Fe в щелочных р-рах, Pt
и Ni в кислых. К тому же пассивирующие оксидные слои в нек-рых случаях настолько
тонки, что их трудно считать фазовыми (Cr в к-тах). В пользу адсорбц. концепции
свидетельствует тот факт, что, напр., Ni ведет себя как пассивный металл в серной
к-те с добавлением ионов I- или в диметилсульфоксидных р-рах в условиях,
когда на его пов-сти образуются адсорбц. слой ионов I- или молекул
диметилсульфоксида (фазовые оксидные пленки отсутствуют). Кривая анодного растворения
в области перехода к пассивному состоянию (участок ABCD на рис.) м. б.
рассчитана на основе представлений о конкуренции анодного растворения (р-ции
2,3) и пассивирующей адсорбции кислорода (р-ции 2, 4, 5):
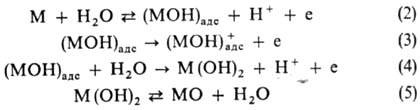
Постоянная скорость растворения
в пассивной области при росте E (участок DE)объясняется тем,
что повышение тока из-за увеличения экспоненц. множителя в ур-нии (1) пол-ностью
компенсируется уменьшением во времени предэкспоненц. множителя kE
за счет дополнит. адсорбции кислорода на пассивную пов-сть.
В рамках каждой из двух
концепций делаются попытки объяснить все факты и эмпирич. закономерности оксидной
П. м. Так, нек-рые сторонники адсорбц. концепции признают существование на пассивной
пов-сти фазового оксида, но основное защитное действие связывают с хемосорбцией
кислорода на границе металл-оксид или оксид-р-р. В нек-рых вариантах пленочной
концепции энергетич. неоднородность пов-сти учитывается при рассмотрении образования
и роста зародышей новой фазы, в процессах нарушения П. м. По-видимому, при оксидной
П. м. адсорбция и образование фазовых пленок должны рассматриваться в неразрывной
связи друг с другом, причем в разл. случаях тот или иной процесс м. б. определяющим.
Практическое значение
П.м. исключительно велико. Она обеспечивает необходимую коррозионную стойкость
конструкций и изделий, изготовляемых из разл. сталей, алюминия, титана и др.
нестойких металлов во многих прир. и технол. средах. Широко применяется самопассивация
металлич. материалов, достигаемая путем легирования добавками, к-рые снижают
критич. ток (напр., Ni, Mo) или и ток, и потенциал пассивации (напр., Cr в кристаллич.
сплавах на основе железа, P и С в аморфных сплавах) (см. Коррозион-ностойкие
материалы). T. наз. катодное легирование сводится к ускорению катодного
восстановления окислителя из-за того, что на пов-сти накапливаются частицы корро-зионностойкой
добавки (напр., Pd или Mo в сплавах на основе Ti), на к-рых катодный процесс
происходит при меньшем перенапряжении. Такого же результата добиваются введением
в среду дополнит. окислителя или повышением его концентрации. Во всех этих случаях
должны выполняться условия: Eкор < Eпрп
или Eкор < Eпиг.
Если самопассивация материала
невозможна или нецелесообразна, для повышения коррозионной стойкости оборудования
используется анодная защита, основанная на принудит. поддерживании электродного
потенциала в пассивной области путем регулирования тока растворения (см. Электрахимическая
защита). Нарушения П. м.- частая причина выхода оборудования из строя, аварий,
преждевременных ремонтов. П. м. может затруднять нск-рые технол. процессы, напр.
электрохим. размерную обработку, электроосаждение металлов с р-римыми
анодами.
Лит.: Колотыркнн Я. M., в сб.: Проблемы физической химии, в. 1, M., 1958; Томашов H. Д., Теория коррозии и защиты металлов, M., 1959; Кабанов Б. H., Электрохимия металлов и адсорбция, M., 1966; Новаков-ский В. M., "Защита металлов", 1979, т. 15, № 1, с. 3-19; Колотыр-кин Я. M., Металл и коррозия, M., 1985; Кеше Г., Коррозия металлов, пер. с нем., M.. 1984; Томашов H. Д., Чернова Г. П., Теория коррозии и корро-зионностойкие конструкционные сплавы, M., 1986; Попов Ю. А., "Электрохимия". 1986, т. 22, № 1, с. 90 95; № 6, с. 762 67; Сухотин A. M., Физическая химия пассивируюших пленок на железе. Л., 1989.



 0,5
0,5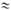 0,7
0,7