ОРГАНИЧЕСКАЯ ХИМИЯ,
наука, изучающая соединения углерода с др. элементами (органические соединения),
а также законы их превращений. Назв. "О.х." возникло на ранней стадии
развития науки, когда предмет изучения ограничивался соед. углерода растит,
и животного происхождения. Не все соед. углерода классифицируются как органические.
Напр., СО2, HCN, CS2 традиционно относят к неорганическим.
Условно можно считать, что прототипом орг. соед. является метан СН4.
К настоящему времени число
известных орг. соед. превышает 10 млн. и увеличивается каждый год на 250-300
тыс. Многообразие орг. соед. определяется уникальной способностью
атомов углерода соединяться друг с другом простыми и кратными связями, образовывать
соед. с практически неогранич. числом атомов, связанных в цепи, циклы, бициклы,
трициклы, полициклы, каркасы и др., образовывать прочные связи почти со всеми
элементами периодич. системы, а также явлением изомерии-существованием
разных по св-вам в-в, обладающих одним и тем же составом и мол. массой.
Многообразие и громадное
число орг. соед. определяет значение О.х. как крупнейшего раздела совр. химии.
Окружающий нас мир построен гл. обр. из орг. соед.; пища, топливо, одежда, лекарства,
краски, моющие ср-ва, ВВ, материалы, без к-рых невозможно создание транспорта,
книгопечатания, проникновение в космос и проч.,-все это состоит из орг. соединений.
Важнейшую роль орг. соед. играют в процессах жизнедеятельности. На стыке О.х.
с неорг. химией и биохимией возникли химия металлоорг. соед. и биоорг. химия
соотв., широко использующие методы и представления О.х. Отдельный раздел О.х.
составляет химия высокомол. соед.: по величине молекул орг. в-ва делятся на
низкомолекулярные (с мол. массой от неск. десятков до неск. сотен, редко до
тысячи) и высокомолекулярные (макромолекулярные; с мол. массой порядка 104-106
и более).
Осн. методом О.х. является
синтез. Развитие методов синтеза в первую очередь способствовало установлению
строения самых сложных соединений. Идеальным завершением процесса определения
структуры молекул орг. соед. является полный синтез (тотальный синтез), т.е.
получение с помощью совершенно однозначных хим. методов соединения, структура
к-рого была предложена на основании изучения др. методами. Орг. синтез-очень
тонкое искусство, и химику, приступающему к синтезу, необходимо совершенное
сочетание теоретич. и практич. знаний с интуитивным подбором ср-в, наиб. подходящих
для построения самых сложных молекул (см. также Органический синтез).
О.х. изучает не только
соед., получаемые из растит. и животных организмов (т. наз. прир. в-ва), но
в осн. соед., созданные искусственно с помощью лаб. или пром. орг. синтеза.
Более того, объектами изучения компьютерной О.х. являются соед., не только не
существующие в живых организмах, но к-рые, по-видимому, нельзя получить искусственно
(напр., гипотетич. аналог метана, имеющий не прир. тетраэдрич. строение, а форму
плоского квадрата, в центре к-рого лежит атом С, а в вершинах-атомы Н).
Орг. синтез связывает О.х.
с хим. пром-стью, как малотоннажной (тонкий органический синтез; произ-во
лекарств, витаминов, жидких кристаллов, ферментов, феромонов и др.), так и крупнотоннажной
(основной органический синтез; произ-во искусств. волокна, пластмасс;
переработка нефти и газа и др.).
Строение орг. соед. устанавливают
с помощью методов анализа орг. соед., включающих помимо элементного анализа
такие физ. методы, как ЯМР, масс-спектрометрия, ИК спектроскопия, рентгеновский
структурный анализ, электронография и др.; развиваются также методы выделения,
очистки и разделения орг. в-в, напр. разл. виды хрома-тографии.
Классификация органических
соединений. Основу орг. соед. составляет незамкнутая (открытая) или замкнутая
цепь углеродных атомов; одно или неск. звеньев цепи м. б. заменено на атомы,
отличные от углерода,-т. наз. гетероатомы, чаще всего О, N, S. По структуре
орг. соед. подразделяют на алифатические соединения - углеводороды и
их производные, имеющие открытую углеродную цепь; карбоциклич. соед. с замкнутой
углеродной цепью (см. Алициклические соединения, Ароматические соединения);
гетероциклические соединения. Углеводороды и их производные, не содержащие
кратных связей, относятся к насыщ. соед., с кратными связями - к ненасыщенным.
От каждого углеводорода
путем замены атомов Н на разл. функц. группы м. б. образован т. наз. генетич.
ряд, напр. этан -
этилхлорид - этанол - ацстальдегид - уксусная к-та. В зависимости от типа функц.
группы орг. сосд. разделяются на классы: углеводороды RH (функц. группа отсутствует),
их галогензамещенные RHal, спирты ROH, альдегиды RCHO, кетоны R2CO,
карбоновые к-ты RCOOH, первичные, вторичные и третичные амины RNH2,
R2NH и R3N, нитросоед. RNO2; тиолы (меркаптаны)
RSH, сульфиды R2S и др. К функц. группам относят также кратные углерод-углеродные
связи. Группы орг. соед. однотипной структуры с одинаковыми функц. группами,
отличающимися друг от друга по кол-ву групп СН2 в углеродной цепи,
составляют гомологический ряд.
Соед., в молекулах к-рых
кроме атомов С и Н и атомов-органогенов (Hal, О, N, S) содержатся атомы др.
элементов, образующих связи с углеродом, относятся к элементоорга-ническим
соединениям (см., напр., Металлоорганические соединения, Мышьякорганические
соединения, Фосфороргани-ческие соединения). О правилах наименования орг.
соед. см. в ст. Номенклатура химическая.
Историческая справка. Истоки
О. х. восходят к глубокой древности (уже тогда знали о спиртовом и уксуснокислом
брожении, крашении индиго и ализарином). Однако в средние века (период алхимии)
были известны лишь немногие индивидуальные орг. в-ва. Все исследования этого
периода сводились гл. обр. к операциям, при помощи к-рых, как тогда думали,
одни простые в-ва можно превратить в другие. Начиная с 16 в. (период ятрохимии)
исследования были направлены в осн. на выделение и использование разл. лек.
в-в: был выделен из растений ряд эфирных масел, приготовлен диэтиловый эфир,
сухой перегонкой древесины получены древесный (метиловый) спирт и уксусная к-та,
из винного камня-винная к-та, перегонкой свинцового сахара-уксусная к-та, перегонкой
янтаря - янтарная. Большая роль в становлении О. х. принадлежат А. Лавуазье,
к-рый разработал основные количеств. методы определения состава хим. соединений.
Слияние химии соединений
растит. и животного происхождения в единую хим. науку О. х. осуществил Й. Берцелиус,
к-рый ввел сам термин и понятие орг. в-ва, образование последнего, по Берцелиусу,
возможно только в живом организме при наличии "жизненной силы".
Это заблуждение опровергли Ф. Вёлер (1828), к-рый получил мочевину (орг. в-во)
из цианата аммония (неорг. в-во), А. Кольбе, синтезировавший уксусную к-ту,
М. Бертло, получивший метан из H2S и CS2, A. M. Бутлеров,
синтезировавший сахаристые в-ва из формалина. В первой пол. 19 в. был накоплен
обширный опытный материал и сделаны первые обобщения, определившие бурное развитие
О. х.: развиты методы анализа орг. соед. (Берцелиус, Ю. Либих, Ж. Дюма, М. Шеврёль),
создана теория радикалов (Вёлер, Ж. Гей-Люссак, Либих, Дюма) как групп атомов,
переходящих неизменными из исходной молекулы в конечную в процессе р-ции; теория
типов (Ш. Жерар, 1853), в к-рой орг. соед. конструировались из неорг. в-в-"типов"
(тип водорода, воды, хлористого водорода, аммиака) замещением в них атомов на
орг. фрагменты; введено понятие изомерии (Берцелиус).
Исследования Э. Франклендом
(1852) металлоорг. соед. позволили установить четырехвалентность углерода, заложить
основы теории валентности (Ф. Кекуле, 1858) и постулировать существование углерод-углеродных
простых и двойных связей. Революц. вклад внес А. Купер (1858), к-рый ввел понятие
валентного штриха. С тех пор и по настоящее время химики используют язык т.
наз. конституционных (структурных) ф-л молекул орг. соед., в к-рых связи между
отдельными атомами обозначаются с помощью одного (простая, или одинарная, связь),
двух (двойная) или трех (тройная) валентных штрихов.
Одновременно продолжается
интенсивное развитие синтеза. Создаются первые пром. произ-ва орг. соед. (А.
Гофман, У. Перкин-старший-синтетич. красители: мовеин, фуксин, цианиновые и
азокрасители). Усовершенствование открытого Н. Н. Зининым (1842) способа синтеза
анилина послужило
основой создания анилинокрасочной пром-сти. В лаборатории А. Байера синтезированы
прир. красители - индиго, ализарин, индигоидные, ксантеновые, антрахиноновые.
Идея неразрывной связи
хим. и физ. св-в молекулы с ее строением, идея единственности этого строения
впервые была высказана Бутлеровым (1861), к-рый создал классич. теорию хим.
строения (атомы в молекулах соединяются согласно их валентностям, хим. и физ.
св-ва соед. определяются природой и числом входящих в их состав атомов, а также
типом связей и взаимным влиянием непосредственно несвязанных атомов). Теория
хим. строения определила дальнейшее бурное развитие О. х.: в 1865 Кекуле предложил
ф-лу бензола, позднее высказал идею об осцилляции связей; В. В. Марковников
и А.М.Зайцев сформулировали ряд правил, впервые связавших направление хим. р-ции
с хим. строением вступающего в р-цию в-ва. Эксперим. данные И. Вислиценуса (1873)
об идентичности структурных ф-л (+)-молочной к-ты (из кислого молока) и (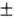 )-молочной
к-ты послужили толчком для создания стереохим. теории (Я. Вант-Гофф и Ж. Ле
Бель, 1874), в к-рой постулировалось тетраэдрич. строение фрагмента с четырехвалентным
атомом углерода, что в случае четырех разл. заместителей предсказывало существование
пространственно-зеркальных изомеров; для соед. с двойной связью (тетраэдры соединяются
по ребру) - наличие геом. изомерии. На этой основе возникла стереохимия-
наука о трехмерной ориентации атомов в молекулах и вытекающих отсюда
следствиях, касающихся св-в соед. (см. также Конфигурация стереохими-ческая,
Конформационный анализ, Молекулярная механика, Оптическая активность, Хиральностъ).
)-молочной
к-ты послужили толчком для создания стереохим. теории (Я. Вант-Гофф и Ж. Ле
Бель, 1874), в к-рой постулировалось тетраэдрич. строение фрагмента с четырехвалентным
атомом углерода, что в случае четырех разл. заместителей предсказывало существование
пространственно-зеркальных изомеров; для соед. с двойной связью (тетраэдры соединяются
по ребру) - наличие геом. изомерии. На этой основе возникла стереохимия-
наука о трехмерной ориентации атомов в молекулах и вытекающих отсюда
следствиях, касающихся св-в соед. (см. также Конфигурация стереохими-ческая,
Конформационный анализ, Молекулярная механика, Оптическая активность, Хиральностъ).
Работами Байера, К. Лаара,
Л. Клайзена, Л. Кнорра развиты представления о таутомерии - подвижной
изомерии. Все эти теоретич. представления способствовали мощному развитию .синтетич.
химии. К кон. 19 в. были получены все важнейшие представители углеводородов,
спиртов, альдегидов и кетонов, карбоновых к-т, галогено- и нитропроизвод-ных,
азот- и серосодержащих структур, гетероциклов арома-тич. природы. Разработаны
методы получения диенов, ацетиленов и алленов (А. Е. Фаворский). Открыты многочисл.
р-ции конденсации (Ш. Вюрц, А. П. Бородин, У. Перкин, Клайзен, А. Михаэль, Ш.
Фридель, Дж. Крафтс, Э. Кнёве-нагель и др.). Исключит. успехи были достигнуты
Э. Г. Фишером в изучении углеводов, белков и пуринов, в использовании ферментов
в орг. синтезе (1894), им же был осуществлен синтез полипептидов. Основой пром-сти
душистых в-в становятся работы О. Валлаха по химии терпенов. Выдающимися даже
для нашего времени являются пионерские работы Р. Вильштеттера [установление
структуры кокаина (1897) и хлорофилла (1907-11)]. Фундам. вклад в развитие орг.
синтеза был внесен В. Гриньяром (1900-20) и Н.Д. Зелинским (1910)-создание исключительно
плодотворного метода синтеза магнийорг. соед. и открытие каталитич. превращений
углеводородов; последнее сыграло выдающуюся роль в развитии химии нефти. Химия
своб. радикалов началась с работ М. Гомберга (1900), открывшим три-фенилметильный
радикал, и была продолжена работами А. Е. Чичибабина, Г. Виланда и Ш. Гольдшмидта.
Разработка Ф. Преглем в
нач. 20 в. методов микроанализа орг. в-в способствовала дальнейшему быстрому
развитию химии прир. соед., что ознаменовалось работами Виланда (1910) по установлению
природы желчных к-т, А. Виндауса (1913-15)-природы холестерина, работами Г.
Фишера (1927-29) по синтезу таких ключевых соед., как порфирин, билирубин и
гемин, У. Хоуорса (Хеуорс)-по установлению структуры углеводов, синтезу витамина
С, П. Каррера, Р. Куна (1911-39)-по получению каротиноидов и витаминов В2,
В6, Е и К; химия алкалоидов, половых гормонов, терпенов была создана
работами А. Бутенандта (1929-61), Л. Ружички (1920-24), А. П. Орехова и Р. Робинсона.
К сер. 20 в. орг. синтез
претерпевает бурное развитие. Это определялось открытием таких основополагающих
процессов, как получение олефинов с использованием илидов (Г.
Виттиг, 1954), диеновый синтез (О. Дильс, К. Альдер, 1928), гидроборирование
непредельных соед. (Г. Браун, 1959), синтез нуклеотидов и синтез гена (А. Тодд,
X. Корана). Не менее значительны успехи в химии металлоорг. соед. (А. Н. Несмеянов,
Г. А. Разуваев). В 1951 был осуществлен синтез ферроцена, установление "сэндвичевой"
структуры к-рого Р. Вудвордом и Дж. Уилкинсоном положило начало химии металлоценовых
соед. и вообще химии орг. соед. переходных металлов. В 1955 Э.О. Фишер синтезировал
дибензолхром и разработал метод синтеза ареновых производных переходных металлов.
В 20-30-е гг. А. Е. Арбузов
создает основы химии фос-форорг. соед., что впоследствии привело к открытию
новых типов физиологически активных соед., комплексонов и др.
В 60-е гг. Г. Шилл осуществил
синтез таких "неклассических" соед., как катенаны и ротаксаны. В
60-80-е гг. Ч. Педерсен, Д. Крам и Ж. М. Лен разрабатывают химию краун-эфиров,
криптандов и др. родств. структур, способных образовывать прочные мол. комплексы,
и тем самым подходят к важнейшей проблеме "мол. узнавания".
Строение органических
соединений. Для орг. соед. характерны неполярные ковалентные связи С—С и
полярные ковалентные связи С—О, С—N, С—Hal, С—металл и т.д. Образование ковалентных
связей было объяснено на основании развитых Г. Льюисом и В. Косселем (1916)
предположений о важной роли электронных образований-октетов и дублетов. Молекула
устойчива, если валентная оболочка таких элементов, как С, N, О, Hal, содержит
8 электронов (правило октета), а валентная оболочка водорода-2 электрона. Хим.
связь образуется обобществленной парой электронов разл. атомов (простая связь).
Двойные и тройные связи образуются соотв. двумя и тремя такими парами. Электроотрицат.
атомы (F, О, N) используют для связи с углеродом не все свои валентные электроны;
"неиспользованные" электроны образуют неподеленные (свободные) электронные
пары. Полярность и поляризуемость ковалентных связей в орг. соед. в электронной
теории Льюиса - Кос-селя объясняется смещением электронных пар от менее электроотрицательного
к более электроотрицат. атому, что находит выражение в индуктивном эффекте
и мезомерном эффекте.
Признание ключевой роли
электронных пар сыграло важную роль в классификации орг. соед., к-рые в случае
реагентов с четным числом валентных электронов были разделены на нуклеофильные
и электрофильные, а р-ции частиц с нечетным числом валентных электронов назвали
радикальными.
Классич. теория хим. строения
и первонач. электронные представления оказались не в состоянии удовлетворительно
описать на языке структурных ф-л строение мн. соед., напр. ароматических. Совр.
теория связи в орг. соед. основана гл. обр. на понятии орбиталей и использует
молекулярных орбиталей методы. Интенсивно развиваются квантовохим. методы,
объективность к-рых определяется тем, что в их основе лежит аппарат квантовой
механики, единственно пригодный для изучения явлений микромира. Методы мол.
орбиталей в О. х. развивались от простого метода Хюккеля к валентных связей
методу, ЛКАО-приближению и др. Широко используются представления о гибридизации
атомных орбиталей. Этап проникновения орбитальных концепций в О. х. открыла
резонанса теория Л. Полинга (1931-33) и далее работы К. Фукуи, Вудворда
и Р. Хофмана о роли граничных орбиталей в определении направления хим. р-ции.
Теория резонанса до сих пор широко используется в О. х. как метод описания строения
одной молекулы набором канонич. структур с одинаковым положением ядер, но с
разным распределением электронов.
Общая характеристика
реакций органических соединений. Р-ции орг. соед. имеют нек-рые специфич.
особенности. В р-циях неорг. соед. обычно участвуют ионы; эти р-ции протекают
очень быстро, иногда мгновенно при нормальной т-ре. В р-циях орг. соед. обычно
участвуют молекулы; при этом одни ковалентные связи разрываются, а другие образуются.
Такие р-ции протекают медленнее ионных (напр., десятки часов), и для их ускорения
часто требуется повысить т-ру или добавить катализатор. Наиб. часто используют
в качестве катализаторов к-ты и основания. Обычно протекает не одна, а неск.
р-ций, так что выход нужного продукта очень часто составляет менее 50%. В связи
с этим в О. х. употребляют не хим. ур-ния, а схемы р-ций без указания стехиометрич.
соотношений.
Р-ции орг. соед. могут
протекать очень сложным образом и вовсе не обязательно соответствовать простейшей
относит. записи. Как правило, простая стехиометрич. р-ция на самом деле происходит
в неск. последоват. стадий. В качестве промежут. соед. (интермедиатов) в многостадийных
процессах могут возникать карбкатионы R+, карбанионы R-,
своб. радикалы 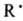 ,
карбены: СХ2, катион-радикалы (напр.,
,
карбены: СХ2, катион-радикалы (напр., 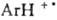 ), анион-радикалы (напр., Аг
), анион-радикалы (напр., Аг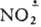 ) и др. нестабильные частицы, живущие доли секунды. Подробное описание всех
изменений, к-рые происходят на мол. уровне в процессе превращ. реагентов в продукты,
наз. механизмом р-ции.
) и др. нестабильные частицы, живущие доли секунды. Подробное описание всех
изменений, к-рые происходят на мол. уровне в процессе превращ. реагентов в продукты,
наз. механизмом р-ции.
Исследование влияния строения
орг. соед. на механизм их р-ций изучает физическая О.х., основы к-рой заложили
К. Инголд, Робинсон и Л. Гаммет (1930-е гг.).
Р-ции орг. соед. м. б.
классифицированы в зависимости от способа разрыва и образования связей, метода
возбуждения р-ции, ее молекулярности и др. (см. Реакции химические).
Взаимод. между реагирующими
молекулами с использованием представлений о мол. орбиталях описывается примерно
так же, как взаимод. между атомами при образовании молекул. Широкое распространение
для этой цели получил метод возмущений мол. орбиталей, на основе к-рого можно
предсказать направление (региохимию) и стереохим. результат р-ции, а также саму
возможность ее осуществления в данных условиях. Использование граничных орбиталей
теории (К. Фукуи, 1952) послужило мощным стимулом к сближению экспериментальной
О.х. с квантовой химией. Подлинным триумфом применения метода мол. орбиталей
в О.х. явилось опубликование в 1965 правил Вудворда-Хофмана, на основе к-рых
можно легко предсказать направление перициклич. р-ций и условия их проведения,
необходимые для получения желаемого стереохим. результата (см. Вудворда-Хофмана
правила, Перициклические реакции).
Развитие О. х. в настоящее
время достигло уровня, позволяющего начать решение такой основополагающей проблемы
О.х., как проблема количеств. соотношения структуры в-ва и его св-ва, в качестве
к-рого может выступать любое физ. св-во (напр., т-ра плавления), биол. активность
любого строго заданного типа (напр., пестицидная) и др. Решение задач такого
типа осуществляется с использованием мат. методов.
Возникновение органических
соединений. Большинство орг. соед. в природе образуется в процессе фотосинтеза
из диоксида углерода и воды под действием солнечного излучения, поглощаемого
хлорофиллом в зеленых растениях. Однако орг. соед. должны были существовать
на земле и до возникновения жизни, к-рая не могла появиться без них. Первичная
земная атмосфера около 2 млрд. лет назад имела восстановит. св-ва, т. к. в ней
не было кислорода, а содержались прежде всего водород и вода, а также СО, азот,
аммиак и метан.
В условиях сильного радиоактивного
излучения земных минералов и интенсивных атм. разрядов в атмосфере протекал
абиотич. синтез аминокислот по схеме:
CH4 + H2O
+ NH3 Аминокислоты
Аминокислоты
Возможность такой р-ции
в настоящее время доказана лаб. опытами. Аминокислоты (из к-рых состоят белки)
накапливались в океане вместе с др. в-вами и постепенно превращались во все
более сложные орг. в-ва, пока, наконец, не появилась возможность создания живой
клетки.
Лит.: Чичибабин
А. Е., Основные начала органической химии, 6 изд., т. 1-2, М., 1954-58; Каррер
П., Курс органической химии, пер. с нем., 2 над., Л., 1962, Ингольд К., Теоретические
основы органической химии, 2 изд., пер. с англ., М., 1973; Быков Г. В.,
История органической химии. Структурная теория,
физическая органическая химия, расчетные методы, М., 1976; Дьюар М., Догерти
Р., Теория возмущений молекулярных орбиталей в органической химии, пер. с англ.,
М., 1977; Быков Г. В., История органической химии. Открытие важнейших органических
соединении. М., 1978; Общая органическая химия, под ред. Д. Бартона и У. Д.
Оллнса, пер. с англ., т. 1-12, М., 1981-88; Терней А., Современная органическая
химия, пер. с англ., т. 1-12, М., 1981; М а рч Д., Органическая химия. Реакции,
механизмы и структура, пер. с англ., т. 1-4. М., 1987-88; Beilsteins Handbuch
der organischen Chemie, 4 Aufl., bearb. von B. Prager [u.a.], Bd 1-31, В., 1918-40
(с 1928 г. изд. доп. тт.); Houben -Weyl, Methoden der organischen Chemie,
4 Aufl., Bd 1 20, Stuttg., 1952-88.
Я. С. Зефиров.


