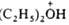ОКСОНИЕВЫЕ СОЕДИНЕНИЯ
(оксониевые соли, соли оксония), содержат положительно заряженный атом кислорода,
связанный ковалентно с орг. остатками и(или) водородом и ионной связью с анионом.
Простейшие неорганические
О. с.-соли гидроксония [Н3О] + Х-, существующие
обычно только в р-рах к-т; в кристаллич. состоянии получены лишь соед. с анионами
, 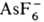 (т.
разл. 193°С) и
(т.
разл. 193°С) и 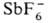 (т. разл. 357 °С).
(т. разл. 357 °С).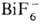
Органические О. с. в зависимости
от числа орг. остатков у атома О подразделяют на первичные, вторичные и третичные.
Наиб. устойчивы и больше всего изучены третичные О. с. Известны след, типы третичных
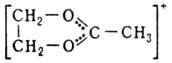
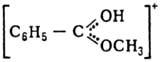
О. с.: [R3O]+X-, где R-алкил или арил; карбоксониевые
(алкоксикарбониевые) соли - производные карбонильных соед. (напр., соед. ф-л
I или II) и диалкилацилоксониевые соли (напр., III):
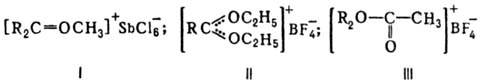
Карбоксониевые соед. м.
б. представлены резонансом структур, напр.: 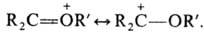 К О. с. относят также пирилия соли с оксониевым атомом кислорода в 6-членном
ароматич. цикле и "оксановые" соед., в к-рых оксониевый атом кислорода
соединен ковалентно с тремя атомами металла и ионной связью с анионом, напр.
[(ClHg)3O]+Cl-или [(Ph3PAu)3O]
+ BF-4 .
К О. с. относят также пирилия соли с оксониевым атомом кислорода в 6-членном
ароматич. цикле и "оксановые" соед., в к-рых оксониевый атом кислорода
соединен ковалентно с тремя атомами металла и ионной связью с анионом, напр.
[(ClHg)3O]+Cl-или [(Ph3PAu)3O]
+ BF-4 .
ТЕМПЕРАТУРЫ ПЛАВЛЕНИЯ
ОКСОНИЕВЫХ СОЕДИНЕНИЙ, °С
|
Катион |
Анион |
||
|
SbCl-6 |
BF-4 |
FeCl-4 |
|
|
(СН3)3О+ |
156-158 |
141 |
81 |
|
(С2Н5)3O+ |
131 |
92 |
74 |
|
(С6Н5)3O+* |
- |
226 |
- |
|
|
149 |
- |
53 |
|
[С6Н5СН=
OCH3]+ |
166 |
- |
(с разл.) |
|
|
121-123 |
164-166 |
- |
|
[(СН3O)2С
= ОСН3]+ |
130-131 |
138 |
- |
|
[С2Н5СН=ОН]+ |
181 |
- |
- |
|
|
112-114 |
- |
- |
* Т.пл. [(С6Н5)3O]+Вг-
182°С, [(С6Н5)3О]+I- 177-178°C.
Свойства. О. с.
-кристаллич. солеобразные в-ва (см. табл.), раств. в полярных р-рителях (ацетон,
CH3CN, CH3NO2, C6H5NO2,
жидкий SO2), не раств. в диэтиловом эфире и углеводородах. Р-ры О.
с. в воде электропроводны, по элект-рич. проводимости [(CH3)3O]
+ BF-4 близок к KI.
Алифатические и ароматические
О. с. различаются геометрией молекул. Катион [(С2Н5)3О]+
имеет строение тригон. пирамиды с атомом О в вершине, расстояние между к-рым
и плоскостью связанных с ним атомов углерода 0,0413 нм. В спектрах ПМР алифатических
и ароматических О. с. наблюдается сдвиг сигналов соотв. 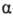 -Н-атома
и орто-Н-атома в слабое поле примерно на 1 м. д. по сравнению с соответствующими
простыми эфирами.
-Н-атома
и орто-Н-атома в слабое поле примерно на 1 м. д. по сравнению с соответствующими
простыми эфирами.
Алифатические О. с. устойчивы
только при наличии комплексных анионов, обладающих слабыми нуклеоф. св-вами
(ВF-4, РF-6 , 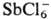 и т. п.), и легко разрушаются водой и спиртами. Особенно лабильны первичные
и вторичные О. с., быстро гидролизующиеся уже влагой воздуха; для третичных
О. с. устойчивость в сильной степени зависит от природы аниона и уменьшается
в ряду:
и т. п.), и легко разрушаются водой и спиртами. Особенно лабильны первичные
и вторичные О. с., быстро гидролизующиеся уже влагой воздуха; для третичных
О. с. устойчивость в сильной степени зависит от природы аниона и уменьшается
в ряду: 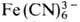
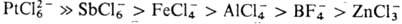 . Ароматич. третичные
О. с. очень устойчивы и химически довольно инертны, они не реагируют с водой
и разлагаются лишь при сильном нагревании:
. Ароматич. третичные
О. с. очень устойчивы и химически довольно инертны, они не реагируют с водой
и разлагаются лишь при сильном нагревании:
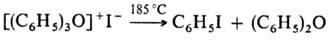
Третичные алифатические
О. с.-одни из самых сильных алкилирующих агентов, в очень мягких условиях легко
алкилируют не только спирты, фенолы, орг. к-ты, амины, сульфиды, но и соед.,
не алкилирующиеся обычными реагентами (AlkHal, Alk2SO4),
напр, амиды к-т, сложные эфиры, кетоны, сульфоксиды, тиофен (по атому серы):
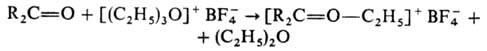
С помощью третичных алифатических
О. с. синтезированы чрезвычайно реакционноспособные ацетали амидов к-т и лактамов,
нитрилиевые соли (последние м. б. восстановлены до вторичных аминов) и эфиры
нитроновых к-т, напр.:
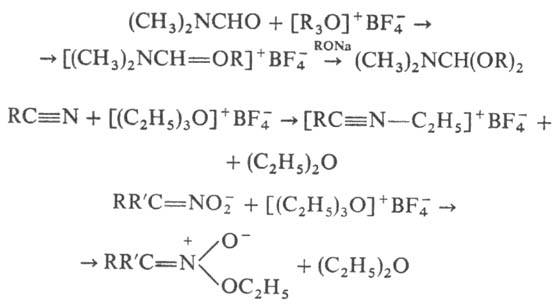
Карбоксониевые соед. могут
реагировать с нуклеофилами по атому О или по атому С, напр.:
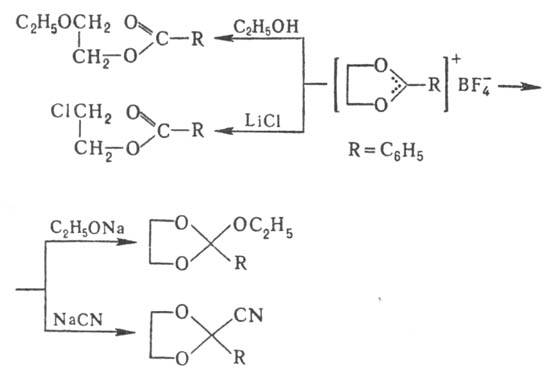
О. с. могут использоваться
для замены анионов в ониевых солях, напр.:
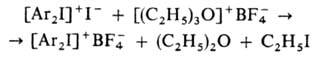
Соли трифенилоксония в
отличие от своих алифатич. аналогов плохо реагируют с нуклеофилами:
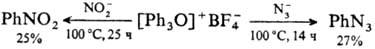
Они также трудно вступают
в р-ции электроф. замещения; при этом в отличие от др. ароматич. ониевых соед.
(см., напр., Галогенониевые соединения)замещение протекает в пара-положение,
напр.:
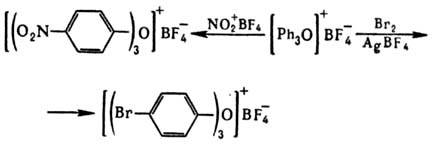
Получение и применение.
Общие способы получения третичных О. с. 1) Действием алкилгалогенидов на
эфираты BF3 или SbCl5:
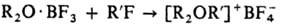
2) Взаимод. простых эфиров
с алкилгалогенидами в присут, безводного AgBF4:
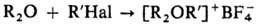
3) Алкилированием гидроксониевых
солей или первичных и вторичных О. с. диазометаном, напр.:
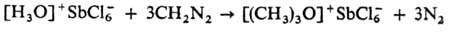
Борофторид триэтилоксония
получают след, образом:
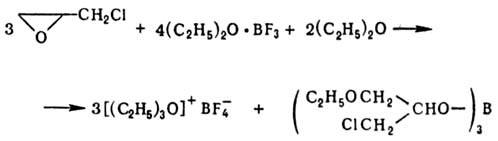
Третичные карбоксониевые
соли получают: алкилирова-нием карбонильных соед. третичными О. с. или алкилгалогенидами
в присут. безводного AgBF4, а также действием BF3 или
SbCl5 на ортоэфиры:
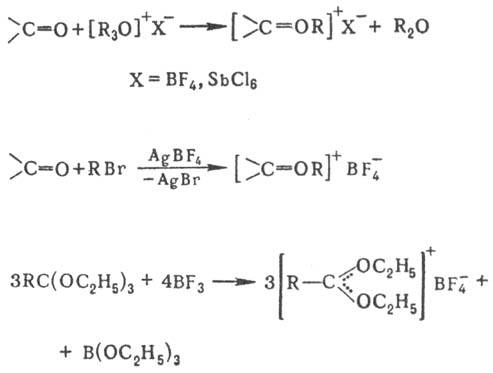
Первичные и вторичные О.
с. получают взаимод. спиртов, простых эфиров или кетонов с комплексными к-тами
[H4Fe(CN)6 , H3Fe(CN)6, H3Co(CN)6
, H2PtCl6] или с гало-генидами металлов (SbCl5
, FeCl3 , AlCl3 , SnCl4, ZnCl2)
и безводным НСl. Р-цию проводят при т-ре от -70 до - 80 °С при полном отсутствии
влаги, напр.:
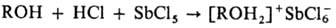
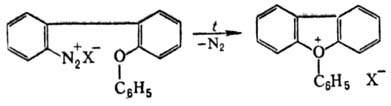
Ароматические О. с. получают
термолизом борофторидов арилдиазония в дифениловом эфире или внутримол. циклизацией
нек-рых диазосоед., напр.:
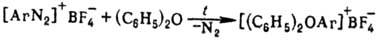
О. с. применяют гл. обр.
в качестве катализаторов катион-ной полимеризации и как алкилирующие агенты.
Иногда их используют для активации инертных карбонильных групп и в качестве
акцептора гидрид-иона.
Лит.: Несмеянов А. Н., Избр. труды, т. 2, М., 1959, с. 458-60, 467-72; т. 3, М., 1959, с. 325-65; Houben-Weyl, Methoden der organischen Chemie, 4 Aufl., Bd 6, Tl 3, Stuttg., 1965, S. 325-65; Perst H., Oxonium ions in organic chemistry, RY., 1971. Т.П. Толстая.