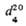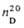ОКСИНИТРИЛЫ (гидроксинитрилы,
нитрилы гидрокси-карбоновых к-т), содержат в молекуле гидроксильную и нитрильную
группы. В зависимости от взаимного расположения этих групп различают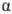 -О.
(циангидрины) RR'C(OH)CN,
-О.
(циангидрины) RR'C(OH)CN, 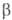 -О. RR'C(OH)CH2CN,
-О. RR'C(OH)CH2CN, 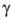 -О.
RR'C(OH)CH2CH2CN и т.д. О.-бесцв. жидкости или кристаллы
(см. табл.), хорошо раств. в орг. р-рителях; низшие алифатические О. легко раств.
в воде, ароматич. и высшие алифатич.- плохо.
-О.
RR'C(OH)CH2CH2CN и т.д. О.-бесцв. жидкости или кристаллы
(см. табл.), хорошо раств. в орг. р-рителях; низшие алифатические О. легко раств.
в воде, ароматич. и высшие алифатич.- плохо.
СВОЙСТВА НЕКОТОРЫХ ГИДРОКСИНИТРИЛОВ
|
Соединение |
Мол. м. |
Т. пл., °С |
Т. кип., oС
(мм рт. ст.) |
|
|
||
|
HOCH2CN |
57,052 |
-67 |
119(24) |
1,104 |
1,4117 |
||
|
CH3CH(OH)CN |
71,079 |
-40 |
102(30) |
0,988 |
1,4048 |
||
|
(CH3)2C(OH)CN |
85,106 |
-19 |
81(15) |
0,930 |
1,3922 |
||
|
C6H5CH(OH)CN |
133,150 |
-10 |
170(760) с разл. |
1,117 |
1,5315 |
||
|
HOCH2CH,CN |
71,079 |
-46 |
110(5) |
1,059 |
1,4256 |
||
|
4-HOC6H4CN |
119,123 |
ИЗ |
- |
- |
- |
||
О. вступают в р-ции, характерные
для нитрилов и спиртов. Кислотный гидролиз приводит к соответствующим
гидро-ксикислотам или их амидам, напр.:
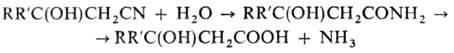
При действии конц. H2SO4
на а-О. одновременно с гидролизом в ряде случаев идет дегидратация с образованием
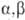 -ненасыщ.
к-т (эту р-цию используют для получения метакриловой к-ты и ее производных).
При действии Р2О5, SOCl2 или
при нагр. до 200-600 °С в присут. катализаторов (HCOONH4, H3PO4
и др.)
-ненасыщ.
к-т (эту р-цию используют для получения метакриловой к-ты и ее производных).
При действии Р2О5, SOCl2 или
при нагр. до 200-600 °С в присут. катализаторов (HCOONH4, H3PO4
и др.) 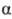 -
и
-
и 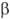 -О. отщепляют
воду с образованием
-О. отщепляют
воду с образованием 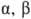 -ненасыщ.
нитрилов; напр., из CH3CH(OH)CN или HO(CH2)2CN
образуется акрилонитрил. Гидрирование О. в присут. Ni и др. катализаторов приводит
к аминоспир-там, напр.: RR'C(OH)CN + H2
-ненасыщ.
нитрилов; напр., из CH3CH(OH)CN или HO(CH2)2CN
образуется акрилонитрил. Гидрирование О. в присут. Ni и др. катализаторов приводит
к аминоспир-там, напр.: RR'C(OH)CN + H2  RR'C(OH)CH2NH2.
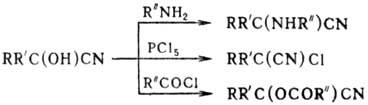
О. реагируют с NH3, аминами, гидразинами, РСl5, хлорангид-ридами
карбоновых к-т, напр.:
RR'C(OH)CH2NH2.
О. реагируют с NH3, аминами, гидразинами, РСl5, хлорангид-ридами
карбоновых к-т, напр.:
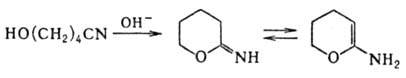
Для О. характерна склонность
к циклизации, напр. с образованием циклич. иминоэфиров:
В пром-сти и в лаб. практике
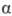 -О. получают
в осн. взаимод. HCN с карбонильными соед., напр.:
-О. получают
в осн. взаимод. HCN с карбонильными соед., напр.:
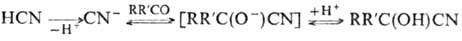
В р-цию вступают все алифатич.
и большинство ароматич. альдегидов, почти все алифатич. кетоны, кроме стерически
затрудненных; ароматич. кетоны циангидринов не образуют. Р-цию проводят в водной
или водно-спиртовой среде в присут. КОН, Na2CO3 и др.
катализаторов при 0-50 °С (вариант Ульте) либо используют HCN в момент образования,
действуя СН3СООН на смесь альдегида (или кетона) и цианида щелочного
металла в водном р-ре при 20-30°С (вариант Уреха). Обычно карбонильные соед.
используют в избытке; исключение составляют ароматич. альдегиды из-за побочного
образования продуктов бензоиновой конденсации.  -О.
в щелочной среде неустойчивы и отщепляют HCN, их стабилизируют к-тами (Н3РО4,
H2SO4, ClCH2COOH и др.) в кол-ве 0,2-2% от
массы
-О.
в щелочной среде неустойчивы и отщепляют HCN, их стабилизируют к-тами (Н3РО4,
H2SO4, ClCH2COOH и др.) в кол-ве 0,2-2% от
массы  -О.
и очищают перегонкой в вакууме.
-О.
и очищают перегонкой в вакууме.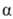 -О.
могут быть получены также действием цианидов на бисульфитное соед. альдегида
или кетона или обменной р-цией между циангидрином кетона (обычно ацетона) и
альдегидом, напр.:
-О.
могут быть получены также действием цианидов на бисульфитное соед. альдегида
или кетона или обменной р-цией между циангидрином кетона (обычно ацетона) и
альдегидом, напр.:
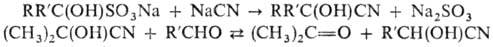
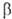 -О. получают взаимод. HCN с
-О. получают взаимод. HCN с 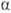 -оксидами
олефинов, напр. этиленоксидом, в присут. MgO, Ca(OH)2 или др. при
40-100°С:
-оксидами
олефинов, напр. этиленоксидом, в присут. MgO, Ca(OH)2 или др. при
40-100°С:
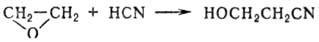
Ароматические О. получают
действием CuCN на галоген-замещенные фенолы в среде пиридина при 150-200 °С
либо окислит. аммонолизом алкилфенолов в присут. молибдатов нек-рых металлов
(напр., Bi) при 500-600 °С:
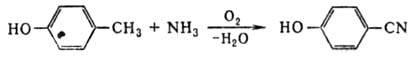
Наиб. пром. значение имеют
ацетонциангидрин, этилен-циангидрин, нитрилы гликолсвой, молочной и миндальной
к-т. О. применяют в произ-ве акрилонитрила, метакрило-нитрила и метакрилатов,
аминокислот, моющих и душистых в-в и полимеров; 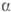 -О.
используют для удлинения цепи моносахаридов на одно звено по Килиани - Фишера
реакции; 4-гидроксибснзонитрил - исходное в-во в пром. произ-ве нек-рых
инсектицидов, напр. цианофоса.
-О.
используют для удлинения цепи моносахаридов на одно звено по Килиани - Фишера
реакции; 4-гидроксибснзонитрил - исходное в-во в пром. произ-ве нек-рых
инсектицидов, напр. цианофоса.
О.-горючи и токсичны, особенно
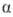 -О., к-рые
по токсичности близки к HCN.
-О., к-рые
по токсичности близки к HCN.
Лит.: Бобков С.
С., Смирнов С. К., Синильная кислота, М., 1970; Зильберман Е. Н., Реакции нитрилов,
М., 1972; Теддер Дж., Нехватал А., Джубб А., Промышленная органическая химия,
пер. с англ., М., 1977.
С. К. Смирнов,