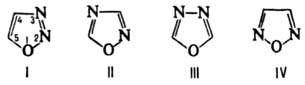
ОКСАДИАЗОЛЫ, мол.
м. 70,06. Различают 1,2,3-, 1,2,4-, 1,3,4- и 1,2,5-О. (ф-лы соотв. I-IV). О.-бесцв.
жидкости или кристаллы (см. табл.). Известны замещенные 1,2,3-О., имеющие структуру
сид-нонов и сиднониминов (см. Мезоионные соединения).
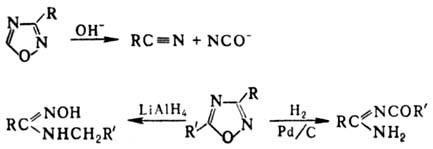
Незамещенный 1,2,4-О.-неустойчивая
жидкость, 3-метил-производное стабильно при 0°С, 5-фенилпроизводное - при
20 °С. 3,5-Дизамещенные производные устойчивы к нагреванию, инертны к действию
конц. H2SO4 и дымящей HNO3. Замещенные 1,2,4-О.
не вступают в электроф. замещение по атомам С цикла. Нуклеоф. замещение легче
всего протекает в положение 5; напр., атом хлора в 5-хлор-3-алкил(арил)-1,2,4-О.
легко замещается на амино-, гидрокси- и алкокси-группы.
Под действием к-т, щелочей
или восстановителей происходит раскрытие цикла, напр.:
3-Винил- и 5-винил-3-фенил-1,2,4-О.
легко полимеризуются; используются для получения синтетич. волокон (см. Термостойкие
волокна).
СВОЙСТВА НЕКОТОРЫХ ОКСАДИАЗОЛОВ
|
Соединение |
Мол. м. |
Т. пл., °С |
Т. кип., °С |
| 1 ,2,4-Оксадиазолы |
|
||
|
5-Метил-З-фенил-
1 ,2,4-оксадиазол |
160,17 |
41-42 |
_ |
|
3-Метил-5-фенил-1,2,4-оксадиазол |
160,17 |
55-56 |
- |
|
3,5- Дифенил-1
,2,4-оксадиазол |
222,25 |
108 |
210/17 мм рт.ст. |
| 1 ,3,4-Оксадиазолы |
. |
||
|
1,3,4-Оксадиазол |
70,06 |
_ |
150-151 |
|
2,5-Диметил-1 ,3,4-оксадиазол |
98,1 |
_ |
178-179 |
|
2-Метил-5-фенил-
1 ,3,4-оксадиазол |
160,17 |
61-64 |
_ |
|
2,5- Дифенил-1
,3,4-оксадиазол |
222,25 |
138-140 |
231/13 мм рт.ст. |
Осн. методы синтеза производных
1,2,4-О.- пиролиз О-ациламидоксимов, конденсация амидоксимов с гидрохлоридами
иминоэфиров, р-ции 1,3-диполярного циклоприсое-динения N-оксидов нитрилов с
нитрилами:
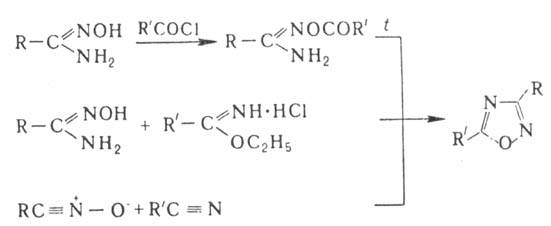
1,3,4-О. и его производные
хорошо раств. в большинстве орг. р-рителей (низшие 2-алкил- и 2,5-диалкил-1,3,4-О.
раств. в воде); образуют комплексные соед. с AgNO3 и HgCl2;
мн. производные 1,3,4-О. обладают высокой термич. стабильностью.
Для 1,3,4-О. и его монозамещенных
р-ции электроф. замещения (нитрование, сульфирование) не характерны, галогенирование
протекает с трудом; 2,5-диарил-1,3,4-О. с галогенами образуют комплексы. Действие
нуклеоф. реагентов на производные 1,3,4-О. обычно приводит к расщеплению цикла
или к образованию др. гетероцикла. Аналогично протекает кислотный или щелочной
гидролиз:
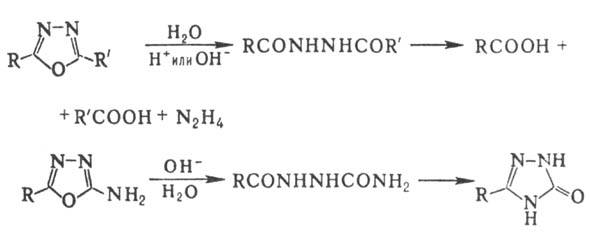
По легкости кислотного
гидролиза замещенные 1,3,4-О. располагаются в ряд: 2-алкил-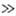 2-арил-
> 2-алкокси-5-арил- > > 2,5-диалкил- > 2-алкил-5-арил
2-арил-
> 2-алкокси-5-арил- > > 2,5-диалкил- > 2-алкил-5-арил 2,5-диарил.
2,5-Диалкил-, 2-алкил-5-арил- и 2,5-диариллроизводные при нагр. с форм-амидом
(170-180 °С) или с первичными ариламинами (240-280 °С) образуют производные
1,2,4-триазола:
2,5-диарил.
2,5-Диалкил-, 2-алкил-5-арил- и 2,5-диариллроизводные при нагр. с форм-амидом
(170-180 °С) или с первичными ариламинами (240-280 °С) образуют производные
1,2,4-триазола:
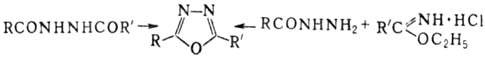
Метод получения незамещенного
1,3,4-О. и его 2-замещен-ных - нагревание N-ацилгидразинов с ортомуравьиным
эфиром:
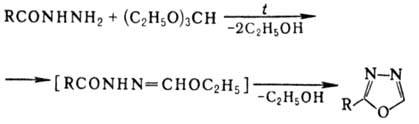
Симметричные 2,5-диалкил-1,3,4-О.
получают взаимод. кар-боновых к-т с N2H4·2HCl в присут.
РОСl3. Др. методы получения 2,5-дизамещенных 1,3,4-О.-внутримол.
циклизация N,N'-диацилгидразинов (дегидратирующие агенты РОСl3, SOCl2,
P2O5, конц. H2SO4) и конденсация
N-ацил-гидразинов с гидрохлоридами иминоэфиров:
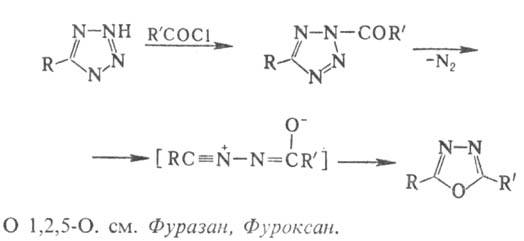
Производные 1,3,4-О. м.б.
синтезированы также и из др. гетероциклич. систем по р-циям рсциклизации, напр.:
Многие 1,2,3-, 1,2,4-,
1,3,4-О. и их производные обладают противовоспалит., антибактериальной, анальгетич.,
противотуберкулезной и противомалярийной активностью, являются эффективными
фунгицидами, инсектицидами и антидепрессантами (сиднофен, сиднокарб). Производные
1,3,4-О. применяют при получении термостойких полимерных материалов (напр.,
линейных и циклич. полиоксадиазолов). 2,5-6ис-(Перфторалкил)-1,3,4-О.
используют в произ-ве р-ри-телей для фторир. полимеров и фотоматериалов (напр.,
фотографич. эмульсий) с повыш. термич. стабильностью. Производные 2,5-диарил-1,3,4-О.-сцинцилляторы
[напр., 2-фенил-5-(4-бифенилил)- и 2-(4-бифенилил)-5-(1-нафтил)-1,3,4-О.], люминофоры,
красители, фотохромные препараты.
Лит.: Насыпов Е.
П., Греков А. П., "Успехи химии", 1964, т. 33, в. 10, с. 1184-97;
Гетероциклические соединения, под ред. Р. Эльдерфилда, пер. с англ., т. 7, М.,
1965; Nonbenzenoid aromatics, ed. by J.P. Snyder, v. 1, N.Y., 1969, p. 117-248;
Clapp L. В., "Adv. Heterocyclic Chem.", 1976, v. 20, p. 65-116;
Ol-lis W.D., Ramsden С. А., там же, 1976, v. 19, p. 1-123.
P. А. Караханов, В.
И. Келарев.


