ОКИСЛИТЕЛИ, в-ва,
молекулы к-рых принимают электроны или отдают кислород в окислит.-восстановит.
р-циях. Относит. окислит. способность в-в определяется путем сравнения изменения
энергий Гиббса при р-циях в-в с одним и тем же восстановителем (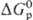 ),
а в случае р-ций между простыми в-вами-сравнением DG0обр
продуктов окисления простого в-ва. Чем больше абс. величина
),
а в случае р-ций между простыми в-вами-сравнением DG0обр
продуктов окисления простого в-ва. Чем больше абс. величина 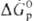 или
или 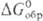 , тем
более активным О. является данное в-во. Так, при обычных условиях в р-циях Са
+ Х2
, тем
более активным О. является данное в-во. Так, при обычных условиях в р-циях Са
+ Х2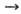 СаХ2
(где X = Cl, F), Са + 1/2O2,
СаХ2
(где X = Cl, F), Са + 1/2O2, 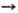 CaO
хлор-более активный О., чем О,, но менее активный, чем F2 (
CaO
хлор-более активный О., чем О,, но менее активный, чем F2 (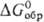 CaO -603,9, СаСl2 -749,3, CaF2 -1168,4 кДж/моль).
CaO -603,9, СаСl2 -749,3, CaF2 -1168,4 кДж/моль).
В случае электрохим. р-ций
или р-ций в р-рах для сравнения окислит. способности в-в используют стандартный
электродный потенциал (пропорционален 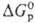 ).
Окислит. св-ва в-в в р-рах зависят от величины рН р-ра.
).
Окислит. св-ва в-в в р-рах зависят от величины рН р-ра.
Сильнейшие О.-атомарные
F, О, Сl, нек-рые своб. радикалы, сильные O.-F2, O2, О3,
Сl2, фториды кислорода, галогенов, благородных газов, фториды, оксиды
и хлориды азота, фториды и оксиды переходных металлов в высоких степенях окисления,
олеум, нек-рые к-ты (конц. HNO3, НСlO4), соли (напр.,
гипохлориты, К2Сг2О7, КМnО4) и комплексные
соед., пероксиды. Нек-рые в-ва проявляют окислит. св-ва в плазменном состоянии
(напр., CF4 или при фотохим. активации (напр., SF6).
О. применяют: при сжигании орг. топлива; для окислит, выплавки металлов из сульфидных руд; для удаления примесей из металлов и сплавов; в орг. и неорг. синтезе; в жидких ракетных топливах и смесевых ВВ; для отбеливания шерсти, хлопка, целлюлозы, шелка; для хим. травления металлов и полупроводников; в хим. источниках тока в составе катодов и др. Э.Г. Раков.


