НЬЮМЕНА-КВОРТА РЕАКЦИЯ
(Ньюмена-Кворта перегруппировка), термич. перегруппировка О-арилтиокар-баматов
в S-арилтиокарбаматы, напр.:
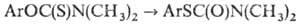
Термолиз проводят при т-ре
ок. 300 °С в инертной атмосфере без р-рителя или в инертном р-рителе. Выход
S-арил-тиокарбаматов обычно 70-95%.
Аналогично осуществляются
перегруппировки эфиров тионкарбоновых к-т в эфиры тиолкарбоновых к-т (т. наз.
п е р е г р у п п и р о в к а Ш ё н б е р г а, открыта А. Шёнбергом в
1930), О-эфиров дитиоугольной к-ты (ксантогенатов) в S-эфиры этой же к-ты. Показано,
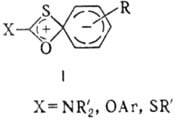
что все эти перегруппировки осуществляются через четырехцентровое переходное
состояние в результате ипсо-атаки по атому углерода (ф-ла I).
Перегруппировка легко протекает
даже при наличии в ароматич. кольце
дезактивирующих алкильных групп. Образование побочных
продуктов отмечено только в случае миграции 2-тpет-бутил-4,6-динитрофенильного
радикала.
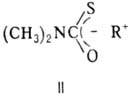
В условиях, подобных Н.-К.р.,
перегруппировка ROC(S)— —N(CH3)2 осуществляется легко
только в тех случаях, когда молекула содержит О-бeнзильную, О-бeнзгидрильную
или О-алкильную группу, имеющую в b-положении гетероатом с
неподеленной электронной парой. В этих случаях интерме-диатом является ионная
пара (II).
Изомеризация О-аллильных
и замещенных О-аллильных тионоэфиров
происходит в очень мягких условиях по механизму [3,3]-сигматропного сдвига:
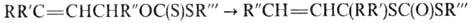
Н.-К.р. используют для
синтеза тиофенолов, к-рые получают гидролизом S-арилдиалкилтиокарбаматов. Она
открыта М. Ньюменом и независимо от него X. Квортом в
Лит.: Общая органическая
химия, пер. с англ., т. 5, М., 1983, с. 138-40; Newman M.S., Karnes H.A., "J.
Org. Chem.", 1966, v. 31, № 12, p. 3980-84; Kwart H., Evans E.R., "J.
Org. Chem.", 1966, v. 31, № 2, p. 410-13.
В. Н. Дрозд.


