НУКЛЕИНОВЫЕ КИСЛОТЫ
(полинуклеотиды), биополимеры, осуществляющие хранение и передачу генетич.
инфор-мации во всех живых организмах, а также участвующие в биосинтезе белков.
Первичная структура Н.к. представляет собой последовательность остатков нуклеотидов. Последние в молекуле Н.к. образуют неразветвленные цепи. В зависимости от природы углеводного остатка в нуклеотиде (D-дезоксирибозы или D-рибозы) Н.к. подразделяют соотв. на дезоксирйбонуклеи-новые (ДНК) и рибонуклеиновые (РНК) к-ты. В молекуле ДНК гетероциклы, входящие в остаток нуклеотида, представлены двумя пуриновыми основаниями - адeнином (А) и гуанином (G), и двумя пиримидиновыми основаниями -тими-ком (Т) и цитозином (С); РНК вместо Т содержит урацил (U). Кроме того, в Н.к. в небольших кол-вах обнаруживаются модифицированные (в осн. метилированные) остатки нуклеозидов- т. наз. минорные нуклеозиды, к-рыми особенно богаты транспортные рибонуклеиновые кислоты (тРНК). Отдельные нуклеотидные остатки связаны между собой в полинуклеотидных цепях 3'-5'-фосфодиэфирными связями (см. ф-лу). Стандартная запись нуклеотидной последовательности осуществляется в направлении от 5'-конца к 3'-концу (каждый нуклеотид обозначают буквой, присвоенной основанию, к-рое он содержит; напр., последовательность приведенного участка ДНК записывается как ACGT).
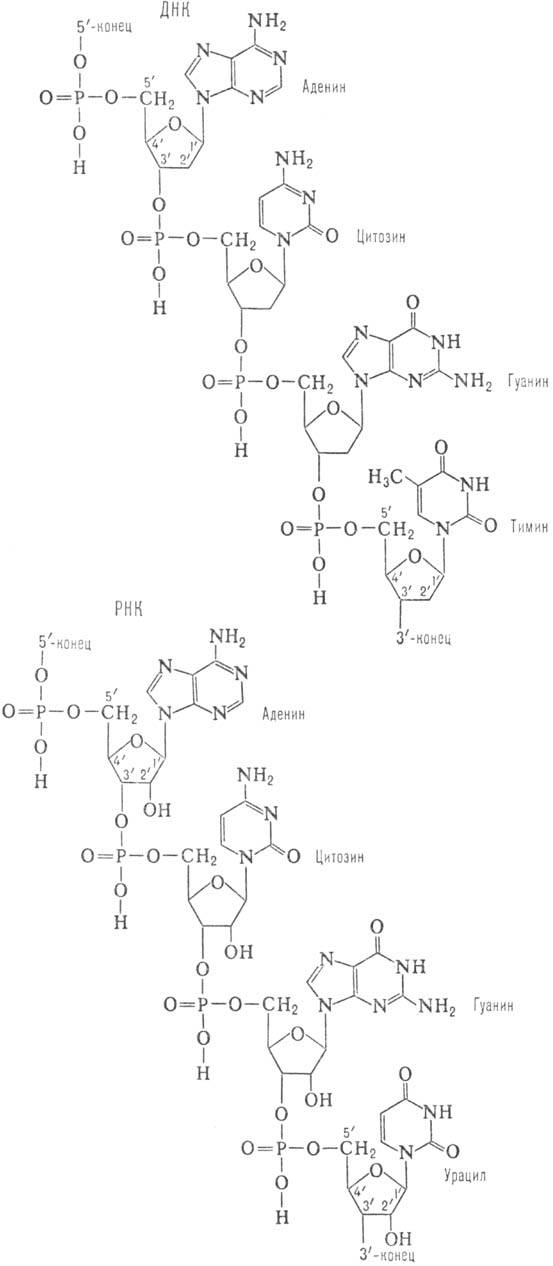
Св-ва ДНК и РНК различны.
Так, РНК легко расщепляется щелочами до мононуклеотидов (благодаря наличию группы
2'-ОН), в то время как полинуклеотидные цепи ДНК в тех же условиях стабильны.
Это структурное различие определяет и меньшую устойчивость к воздействию к-т
N-гликозидных связей (связь между гетероциклом и остатком рибозы) в ДНК по сравнению
с РНК.
Дсзоксирибонуклепновые
кислоты. Нуклеотидный состав ДНК подчиняется ряду правил (т.наз. п р а в и л
а Ч а р г а ф-ф а), важнейшее среди к-рых-одинаковое содержание А и Т, G и С
у любой клеточной ДНК. Нуклеотидный состав РНК подобным правилам не подчиняется.
Пространствю структура
ДНК описывается как комплекс двух полинуклеотидных антипараллельных цепей (рис.
1), закрученных относительно общей оси, так что углевод-фосфатные цепи составляют
периферию молекулы, а азотсодержащие гетероциклы направлены внутрь (д в о й
н а я с п и р а л ь У о т с о н а-К р и к а). Антипараллельность полинуклеотидных
цепей выражается в том, что на одном и том же конце спирали одна полинуклеотидиая
цепь содержит (незамещенную или замещенную) группу 5'-ОН, а другая 3'-ОН. Фундам.
св-во двойной спирали ДНК состоит в том, что ее цепи комплементарны друг другу
(см. Комплемен-тарностъ)вследствие того, что напротив А одной цепи всегда
находится Т другой цепи, а напротив G всегда находится С. Комплементарное спаривание
А с Т и G с С осуществляется посредством водородных связей. Классич. двойная
спираль Уотсона-Крика получила назв. В-формы ДНК. Она-правозакрученная, плоскости
гетероциклич. оснований перпендикулярны оси спирали, а число пар остатков нуклеотидов
на один виток спирали равно примерно 10; расстояние между витками 3,4 нм. При
изменении ионной силы и состава р-рителя двойная спираль изменяет свою форму
и даже может превращ. в левозакрученную спираль (т.наз. Z-форму), к-рая содержит
в одном витке ок. 12 остатков нуклеотидов. При дегидратации В-формы образуется
А-форма ДНК-правозакрученная двойная спираль, содержащая в одном витке ок. 11
остатков нуклеотидов, плоскости гетероциклич. оснований повернуты примерно на
20° относительно перпендикуляра к оси спирали. Двойная спираль ДНК способна
денатурировать (напр., при повышении т-ры) с полным расхождением комплементарных
цепей, к-рые сохраняют способность к ассоциации с восстановлением
(рекатурацией) двойной спирали при возвращении к исходным условиям. Подробно
изучены также кон-формации фрагментов ДНК.
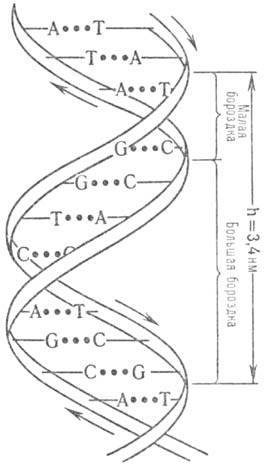
Рис. 1. Двойная спираль
ДНК (стрелками показано направление
полинуклеотидной цепи). .
Установлено, чго молекула
ДНК в клетке представляет собой совокупность генов, регуляторных участков
(последовательностей, связывающихся с регуляторными белками и управляющих
уровнем экспрессии генов), районов, участвующих в организации генов в
хромосомах, а также последовательностей, ф-ции к-рых еще не известны.
У прокариот (бактерии и
синезеленые водоросли) ДНК организована в виде компактного образования-н у к
л е о и-д а, к-рый содержит всю хромосомную ДНК клетки длиной в неск. миллионов
пар нуклеотидов (м.п.н.). Кроме того, у мн. прокариог и эукариот (все организмы,
за исключением прокариот) обнаружены ьнехромосомные ДНК (т. наз. плаз-миды)размером от неск. тысяч пар нуклеотидов (т.п.н.) до неск. десятков т.п.н.
(м.п.н. и т.п.н.-принятые единицы длины двухцепочечной молекулы Н.к.)-
Мн. ДНК образуют кольцевые
структуры. В том случае, если обе полинуклеотидные цепи ДНК ковалентно непрерывны,
ДНК может находиться в сверхспирализованной (сверхскрученной) форме (рис. 2).
В клетках сверхспирализация
осуществляется ферментами ДНК-гиразами (топоизомеразами
II).
Хромосомные ДНК эукариот
локализованы в клеточном ядре, где
вместе с гистонами и негистоновыми белками образуют хроматин -ну-клеопротеид,
из к-рого организованы хромосомы. Размеры ДНК в отдельных эукариотич.
хромосомах колеблются в широких пределах-от 103 до 105
т.п.н.
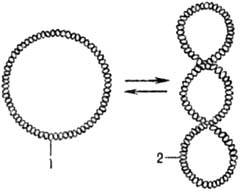
Рис. 2. Сверхспирализация
двухцепочечной кольцевой ДНК под
действием ДНК-гиразы: 1 - кольцевая форма ДНК; 2
- сверхспирализованная форма ДНК.
Геномы мн. вирусов бактерий (бактериофагов), животных и в более редких случаях растений представлены ДНК. Такие клеточные органеллы, как митохондрии и хлоропласты, имеют также свою собственную ДНК размером от неск. десятков до неск. сотен т.п.н.
Биосинтез ДНК осуществляется
в результате репликации-точного самокопирования (самовоспроизведения)
путем синтеза новой молекулы ДНК на исходной ("материнской"), к-рая
играет роль матрицы. Этот процесс осуществляется под действием фермента ДНК-полимеразы.
Матрицей для синтеза ДНК может служить также однотяжевая (одноцепочечная) РНК,
комплементарное копирование к-рой осуществляет фермент обратная транскриптаза.
Рибонуклеиновые кислоты.
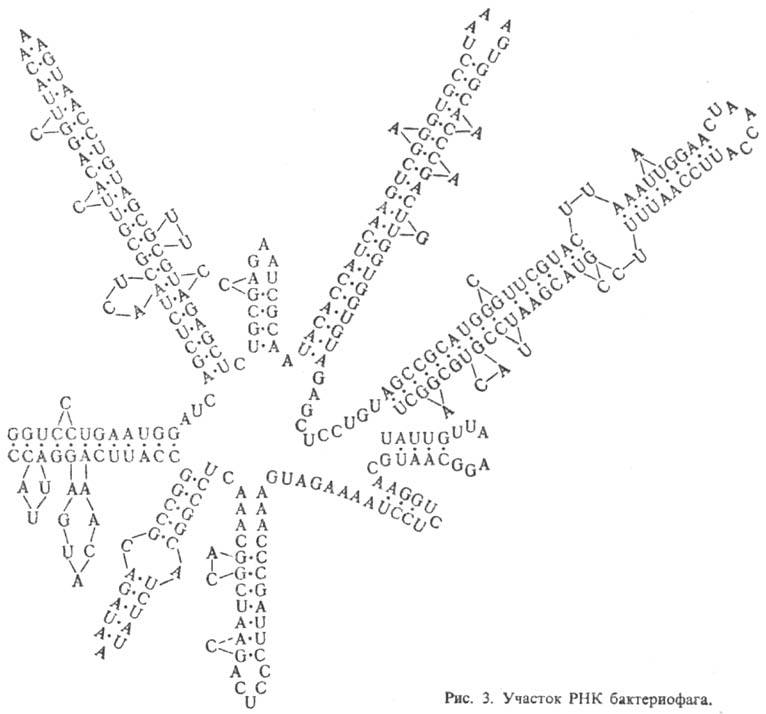
РНК, как правило, построены из одной
полинуклеотидной цепи, характерный элемент вторичной структуры к-рой - "шпильки",
перемежающиеся однотяжевыми
участками (рис. 3). Шпилька - двутяжевая спиральная структура,
образующаяся в результате комплементарного спаривания
оснований (А с U и G с С). Шпильки и соединяющие их одно-тяжевые участки РНК
укладываются в компактную третичную структуру.
Для тРНК вторичная структура имеет характерную форму, к-рую наз. "клеверным
листом". Известны редкие примеры целиком двухспиральных молекул РНК.
Двухспиральные гибридные
комплексы (ДНК и РНК) м.б.
искусственно получены из комплементарных однотя-жевых ДНК и РНК. Функциональноактивные
РНК имеют размер от 70-150 до неск. тысяч нуклеотидных остатков. Биосинтез РНК
(транскрипция)обычно происходит в результате комплементарного копирования
ДНК-матрицы, к-рое осуществляет фермент РНК-полимераза.
Известно неск. типов РНК.
Рибосомные рибонуклеиновые кислоты, связываясь с рибосомными белками,
образуют рибосомы, в к-рых осуществляется синтез белка. Матричные
рибонуклеиновые кислоты служат матрицами для синтеза белков (трансляции).
тРНК осуществляют связывание соответствующей аминокислоты и ее перенос к
рибосомам. Обнаружены т.наз. малые ядерные РНК, участвующие в превращ. первичных
продуктов транскрипции в функционирующие молекулы; т.наз. антисмысловые РНК
участвуют в регуляции биосинтеза белка и репликации плазмидных ДНК. В виде РНК
представлены геномы мн. вирусов (РНК-содержащие вирусы), в к-рых матрицами для
синтеза РНК служат вирусные РНК. Нек-рые РНК обладают ферментативной активностью,
катализируя расщепление и образование фосфодиэфирных связей в своих собственных
или др. молекулах РНК.
Определение первичной
структуры (секвенирование) Н.к. Секвенирование Н.к. позволяет определить
в одном эксперименте последовательность нуклеотидов в ДНК или РНК, содержащих
неск. сотен мономерных звеньев. Методы основаны на общем принципе - определении
с помощью высоко-разрешающего электрофореза в полиакриламидном геле с точностью
до одного нуклеотида длины всех возможных фрагментов секвенируемого участка
Н.к., содержащих на одном конце одну и ту же последовательность нуклеотидов
(гомогенный фрагмент), а на другом-один и тот же нуклео-тид. Такие фрагменты
получают двумя разл. способами. В первом случае (метод Максама-Гилберта) гомогенный
фрагмент ДНК или РНК, предварительно меченный радиоактивной меткой по одному
из концов, расщепляют хим. агентами, специфичными к одному из четырех нуклеотидных
остатков (A, G, С, Т или U); в случае РНК этот процесс осуществляют также специфич.
рибонуклеазами. Расщепление ведут в таких ограничивающих условиях, когда в каждой
молекуле Н.к. расщепляется только одна меж-нуклеотидная связь рядом с нуклеотидом
данного типа, независимо от его положения в цепи. Такую операцию проводят для
каждого из четырех нуклеотидных остатков и по длинам образующихся радиоактивных
фрагментов определяют положение каждого нуклеотида в цепи Н.к.
В др. случае (м е т о д
С е н г е р а) используют олиго- или полинуклеотидную затравку (праймер) известной
длины, коплементарную определенному участку Н.к. Затравку наращивают с помощью
ДНК-полимеразы, останавливая синтез на одном из четырех типов нуклеотидных остатков
с равной вероятностью, независимо от его положения в цепи. Для этого к смеси
четырех прир. субстратов ДНК-полимеразы добавляют т.наз. терминатор (обычно
2', 3'-ди-дезоксинуклеозидтрифосфат) - аналог определяемого нукле-отидного остатка,
попадание к-рого на 3'-конец растущей цепи останавливает синтез. При этом радиоактивная
метка вводится либо в затравку, либо в субстрат. Операцию повторяют для каждого
из четырех нуклеотидов; длину образующихся радиоактивных фрагментов определяют
стандартным способом. Эти методы в настоящее время удалось полностью автоматизировать
(заменив в ряде случаев радиоактивную метку на флуоресцентную) и тем самым в
тысячи раз повысить скорость секвенирования ДНК.
Получение Н.к. В
клетках Н.к. связаны с белками, образуя нуклеопротеиды. Выделение Н.к. сводится
преим. к очистке их от белков. Для этого препараты, содержащие Н.к., обрабатывают
ПАВ и экстрагируют белки фенолом. Послед, очистка и фракционирование Н.к. проводятся
с помощью ультрацентрифугирования, разл. видов жидкостной хрома-тографии и гель-электрофореза.
Для получения индивидуальных Н.к. обычно используют разл. варианты последнего
метода.
Совр. методы хим. синтеза
Н.к. позволяют получать крупные фрагменты ДНК, в т.ч. целые гены. Методич. основы
хим.-ферментативных методов синтеза ДНК разработаны X. Кораной. Они включают:
1) хим. синтез комплементарных, взаимоперекрывающихся олигонукле-отидов, из
к-рых затем в результате комплементационных взаимод. выстраиваются дуплексы
- фрагменты молекулы синтезируемой ДНК с несовпадающими разрывами в обеих цепях;
2) соединение (лигирование) таких олигонуклеотидов в составе дуплекса с помощью
фермента Т4 ДНК-лигазы. Сборку протяженных ДНК из синтетич. однотяжевых олигонуклеотидов
проводят в неск. этапов (рис. 4). Сначала (а) собирают небольшие дуплексы
с "липкими" концами (одно-тяжевыми комплементарными участками),
из к-рых затем последовательно (б, в и т. д.) формируют более протяженные
структуры. Т. обр. могут быть получены искусств. фрагменты ДНК большой длины
и с любой нуклеотидной последовательностью. С помощью генетич. инженерии возможно
клонирование (получение в индивидуальном виде и размножение) искусств. ДНК.
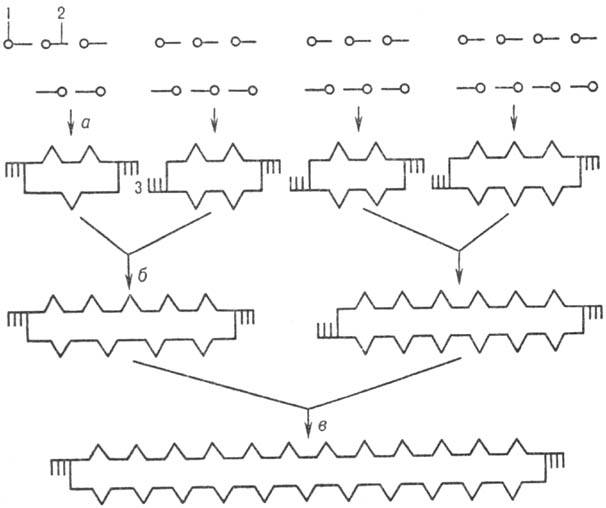
Рис.4. Схема синтеза
полидезоксинуклеотида: 1,- соотв. 5'-
и 3'-конец олигонуклеотидов; 3-комплементарные участки
концов дуплексов (:липкие: концы); а,б и в-стадии
образования дуплексов
(все стадии катализируются Т4
ДНК-лигазой).
Синтез олигодезоксинуклеотидов
Корана осуществил т. наз. фосфодиэфирным методом по схеме:
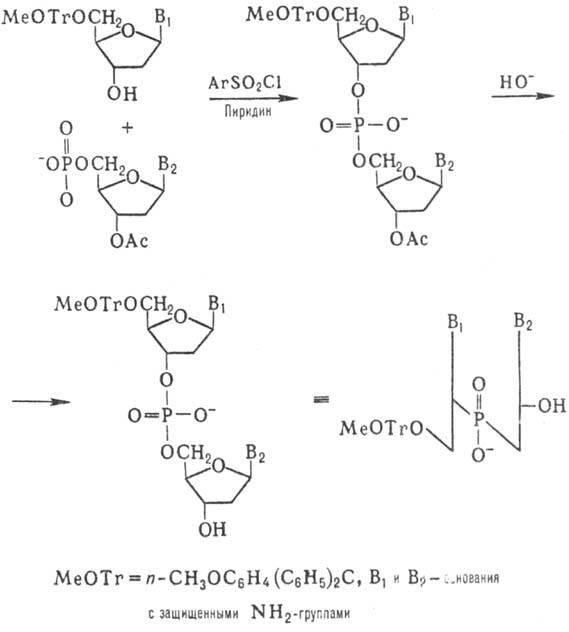
К динуклеотиду со своб.
3'-гидроксильной группой присоединяют таким же способом динуклеотид с незащищенной
5'-фосфатной группой и т.д. (т.наз. блочный метод синтеза):
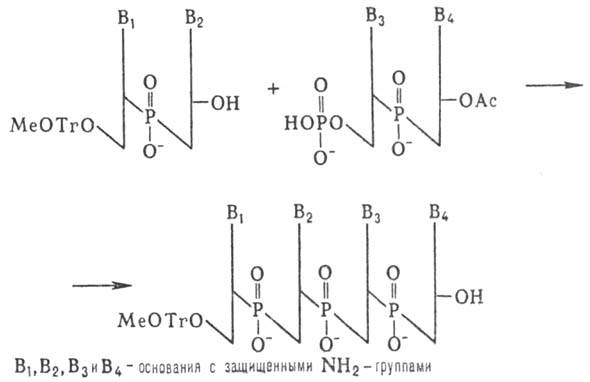
Несмотря на малую эффективность
этого метода, были синтезированы олигонуклеотиды, содержащие до 16 звеньев,
из к-рых были собраны первые синтетич. гены. Фосфоди-эфирный метод образования
межнуклеотидных связей, использованный Кораной, имеет история, значение. Однако
разработанные им приемы введения и избират. удаления защитных групп широко используются
в др. методах синтеза Н.к.
Важным шагом в совершенствовании
синтеза олигонукле-отидов явилась разработка т.наз. фосфотриэфирного метода,
к-рый осуществляют по схеме:
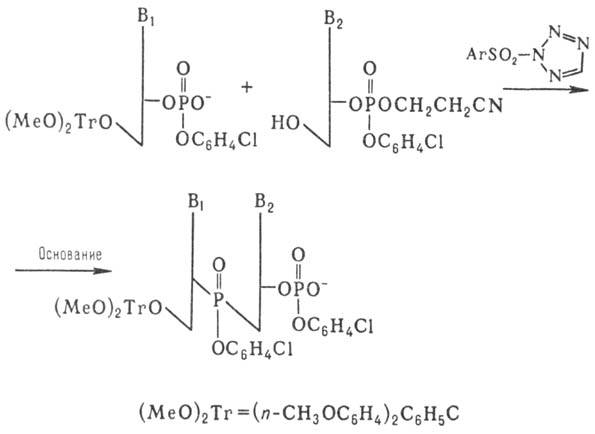
Образующийся динуклеотид
далее (после частичного деблокирования фосфата) конденсируют аналогичным образом
с др. динуклеотидом и т.д. Применение этого способа, в к-ром используют защиту
фосфатной группы, позволило значит. сократить время синтеза и повысить выходы
олиго-нуклеотидов.
Параллельно этим методам,
к-рые осуществляют в р-рах, разрабатывались твердофазные способы синтеза Н.к.
В последнем случае процесс проводят в двухфазной системе; нуклеозидный компонент
связан ковалентно с нерастворимым полимером, а нуклеотидный компонент и необходимые
реагенты находятся в р-ре.
Обычно в этом случае на
первой стадии нуклеозид присоединяют
с помощью "якорной" группы к нерастворимому полимеру.
Затем его 5'-гидроксильную группу деблокируют и
конденсируют с нуклеотидным компонентом. У образующегося полностью защищенного
динуклеозидмонофосфата деблокируют
защитную группу в положении 5' и присоединяют след.
нуклеотид и т.д.
Наиб. распространенные
методы твердофазного синтеза олигонуклеотидов
основаны на использовании нуклеотидного компонента,
содержащего Р(III). В т.наз. амидофосфитном-способе (рис. 5) нуклеотидным компонентом
является эфир 3'-амидофосфита
дезоксинуклеозида. Достаточно устойчивые амидофосфиты
при протонировании в присут. тетразола превращ.
в сильные фосфорилирующие агенты. Схема также включает
блокирование непрореагировавшей 3'-гидроксигруппы
достраивающегося олигонуклеотида (кэпирование) и окисление
межнуклеотидного фосфита. На рис. показан один цикл наращивания цепи, к-рый
длится 5-7 мин и далее повторяется. После завершения синтеза удаляют защитные
группы с межнуклеотидных фосфатов, отделяют олигонуклеотид от носителя, деблокируют
группы NH2 гетероциклов. Липофильную группу (МеО)2Тr удаляют
после первого хроматографич. разделения.
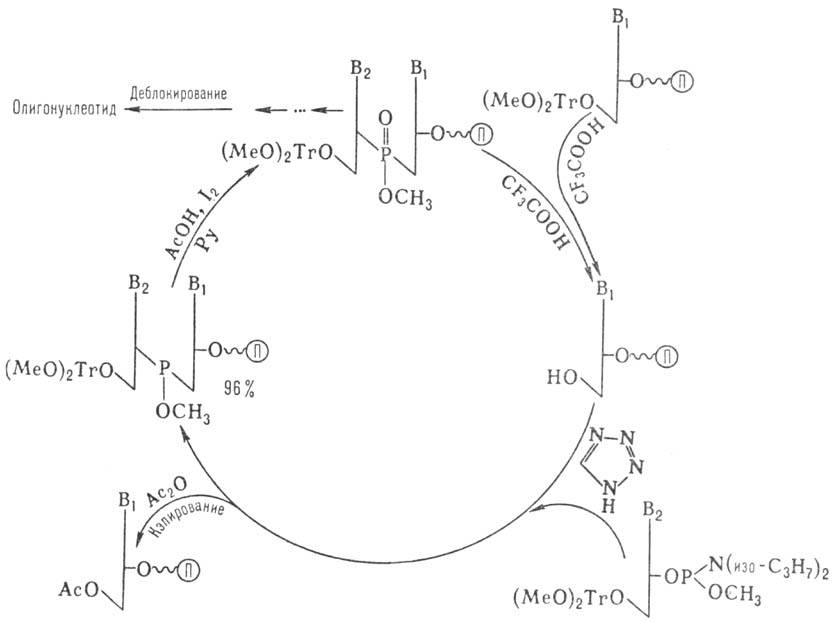
Рис. 5. Схема твердофазного
синтеза олигонуклеотидов амидофосфитным
методом; П - полимерный носитель, Ру-
пиридин.
Др. метод основан на использовании
гидрофосфориль-ного производного нуклеозида:
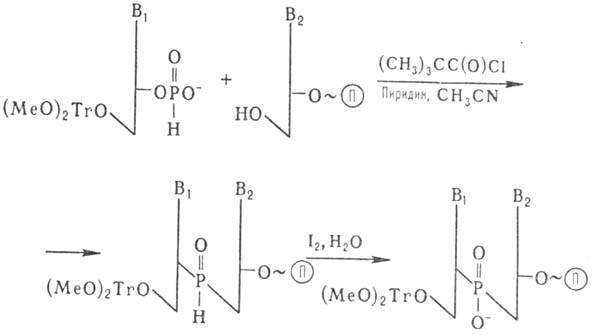
П-полимерный носитель
После снятия 5'-защитной
диметокситритильной группы возможно присоединение след. нуклеотида. Окисление
межнуклеотидных фосфитных групп проводят после завершения синтеза олигонуклеотида.
Стандартность операций
в твердофазном синтезе олиго-нуклеотидов явилась основой для автоматизации процесса.
Принцип работы автомата-синтезатора основан на подаче в реактор с помощью насоса
(под контролем микропроцессора) защищенных нуклеотидных компонентов реагентов
и р-рителей по заданной программе в колонку, содержащую полимерный носитель
с закрепленным на нем первым нукле-озидом. После окончания синтеза и отделения
полностью защищенного олигонуклеотида от полимерного носителя проводят деблокирование,
очистку и анализ синтезир. фрагментов ДНК. Так, с помощью гидрофосфорильного
метода
в автомате-синтезаторе
за неск. часов получают 30-40-звен-ные олигонуклеотиды; возможен синтез более
чем 100-звен-ных фрагментов ДНК. Разработаны синтезаторы, позволяющие проводить
одновременно синтез неск. олигонукле-отидов.
Синтез олигорибонуклеотидов
ферментативным путем осуществляют обычно с использованием рибонуклеаз (РНаз)
или полинуклеотидфосфорилаз (ПНФаз). В первом случае р-цию осуществляют по схеме:
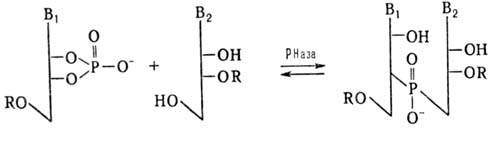
R-H или остаток олигорибонуклеотида
В качестве нуклеотидного
и нуклеозидного компонентов применяют мономеры или олигонуклеотиды. Эту р-цию
используют для синтеза ди-, три- и тетрарибонуклеотидов. При увеличении длины
олигорибонуклеотида начинает преобладать обратная р-ция (гидролиз олигонуклеотида).
Для синтеза олигорибонуклеотидов
с большим числом звеньев используют ПН Фазу:
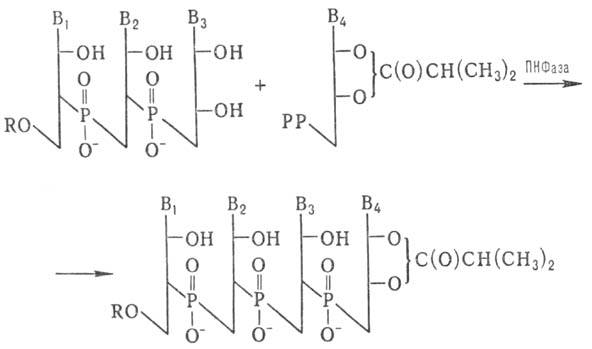
РР-Остаток пирофосфорной
н-ты
Хим. синтез олигорибонуклеотидов
проводят в осн. с использованием тех же приемов, как и при синтезе ДНК. Дополнит.
трудности связаны с селективной защитой 2'-гидроксигруппы рибозы, а также с
неустойчивостью фос-фодиэфирной связи РНК в щелочной среде.
Длинные фрагменты РНК получают
из коротких, соединяя их с помощью РНК-лигазы.
Историческая справка.
Н.к. открыты в 1869-72 Ф. Мише-ром в ядрах (отсюда назв.: лат. nucleus-ядро)
клеток гноя и в сперме лосося. В 1889 Р. Альтман выделил их в чистом виде (им
же предложен термин "Н.к."). В 1944 О. Эйвери показал, что с помощью
ДНК наследств. признаки м. б. переданы от одной клетки к другой и что ДНК, т.
обр., является "в-вом наследственности". Хим. строение Н.к. изучалось
школами А. Косселя, П. Левина, Дж. Гулленда и А. Тодда и было окончательно установлено
к нач. 50-х гг. Макромол. структура ДНК (двойная спираль) установлена в 1953
Дж. Уотсоном и Ф. Криком на основании данных рентгеноструктурного анализа, полученных
Р. Франклин и М. Уилкинсом. Нуклеотидный состав ДНК и РНК из многих объектов
изучен Э. Чаргаффом и А. Н. Белозерским в 40-50-х гг. Изучение первичной структуры
Н. к. начато с сер. 60-х гг. с установления нуклеотидной последовательности
тРНК (Р. Холли). Ф-ции большинства РНК установлены к нач. 60-х гг. Было показано,
что они участвуют в реализации генетич. информации, закодированной в ДНК.
П. Доти и А. С. Спириным
исследовано макромол. строение РНК. В сер. 70-х гг. разработаны эффективные
методы расшифровки первичной структуры ДНК и РНК (методы Максама-Гилберта и
Сенгера), к-рые в сочетании с методами генетич. инженерии позволили в течение
след. десятилетия определить нуклеотидные последовательности мн. генов, плазмид,
вирусных ДНК и РНК, рРНК и др. Разработаны приемы обработки этой информации
с использованием ЭВМ. В 70-х гг. Кораной разработаны методы синтеза ДНК; им
впервые синтезированы прир. гены (аланиновой и тиразиновой транспортных РНК).
Начиная с сер. 70-х гг. создавались методы получения рекомбинантных Н.к. (образуются,
напр., в результате встраивания участка ДНК, в т.ч. гена, в плазмиду; см. Генетическая
инженерия), к-рые существенно расширили возможности структурно-функцион.
исследований Н.к. и создали базу для использования достижений мол. биологии
и генетики в биотехнологии. В 80-е гг. разработаны эффективные методы химического
(в т.ч. автоматического) синтеза олигонуклеотидов и крупных фрагментов ДНК,
к-рые широко используют для изучения структуры и ф-ций Н.к.
Лит.: Шабарова 3. А., Богданов А. А., Химия нуклеиновых кислот и их компонентов, М., 1978; Страйер Л., Биохимия, пер. с англ., т. 3, М., 1985; Уотсон Дж., Туз Дж., Курц Д., Рекомбинантные ДНК, пер. с англ., М., 1986; Зенгер В., Принципы структурной организации нуклеиновых кислот, пер. с англ., М., 1987; Овчинников Ю.А., Биоорганическая химия, М., 1987, с. 295-397. А. А. Богданов, 3. А. Шабарова.


