НОРБОРНАН (норкамфан,
бицикло[2.2.1]гептан, ф-ла I), мол.м. 96,17; т.пл. 87,5-87,8 °С, сублимируется;
DH0обр (газ) — 52,7 кДж/моль; не раств. в воде,
раств. в орг. р-рителях.
Циклогексановое кольцо
молекулы Н. имеет форму ванны.
Искажение валентных углов
приводит к созданию в молекуле значит.
напряжения (энергия напряжения 60,5 кДж/моль).
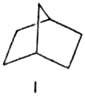
Н. вступает в стереоспецифич.
р-ции радикального
и ионного замещения с образованием только экзо-изомеров, напр. при взаимод.
с оксалилхло-ридом в присут. бензоилпероксида с послед. метанолизом образуется
метиловый эфир экзо-бицикло[2.2.1 ]гептан-2-карбоновой к-ты, а при хлорировании
сулъфурилхлоридом в сульфолане - 2-экзо-хлорнорборнан:
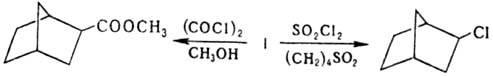
Экзо-изомеры образуются
также в р-циях производных Н.; напр., ацетолиз экзо- и эндо-норборнил-2-тозилата
приводит к экзо-норборнил-2-ацетату; то же соед. образуется и при окислении
эндо- и экзо-норборнил-2-карбоновой к-ты:
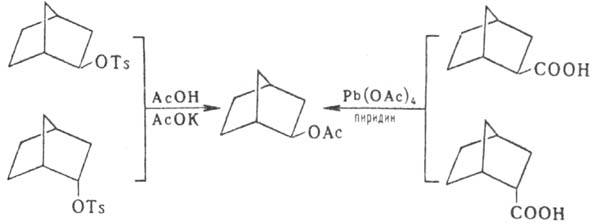
Эндо-изомеры Н.
не могут быть получены из самого Н., для их синтеза используют, напр., норборнен.
Для Н. характерны перегруппировки
углеродного скелета (см., напр., Камфеновые перегруппировку. Особенности
р-ций норборнановых соед. объясняются участием в них неклассич. карбкатионов,
в к-рых заряд распределен между тремя углеродными атомами цикла.
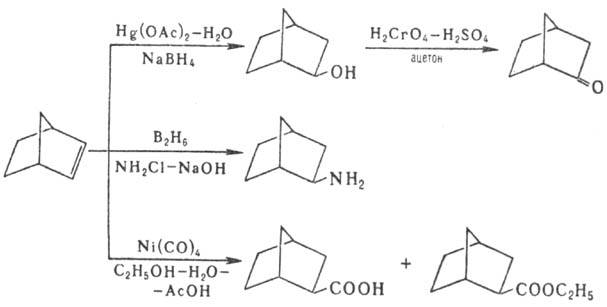
Получают Н. гидрированием
норборнена или норборна-диена. Мн. производные Н. также получают из норборнена,
напр.:
Н.-структурный фрагмент
молекул борнеола, камфоры и др. Его широко используют как модельное соед. для
изучения стереохимии и механизмов р-ций.
Лит.: Общая органическая
химия, пер. с англ., т. 1, М., 1981, с. 40,63, 119-20; Потапов В.М., Стереохимия,
2 изд., М., 1988. Н.В. Зык.


