НЕНИЦEСКУ РЕАКЦИИ. 1.
Восстановит. ацилирование циклоолефинов хлорангидридами карбоновых к-т в присут.
АlСl3 с образованием кетонов (в схеме п = 1,2):
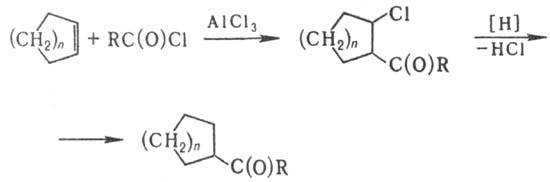
Р-цию осуществляют при
50-70 °С. Источник водорода-циклоалкан, в среде к-рого проводят р-цию:
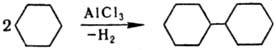
Продукты выделяют фракционированием.
Выходы кетонов 40-70%.
При вовлечении в Н. р.
циклогептена происходит сужение цикла (образуются производные метилциклогексана).
Аналогичное явление наблюдается при использовании нек-рых производных циклогексена
и конденсир. ненасыщ. углеводородов. Вместо циклоолефинов в р-ции можно использовать
соответствующие циклоалканы, из к-рых под действием АlСl3 образуются
циклоолефины. Существенно, что при ацилировании в условиях Н. р. циклогептана,
фенилциклогексана
и конденсир. циклич. углеводородов размеры циклов не уменьшаются.
Предполагают, что механизм Н. р. включает стадию образования катиона ацилия:
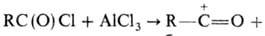
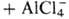 ,
,
к-рый присоединяется к алкену
с образованием карбкатиона (ф-ла I); последний стабилизируется в результате
отрыва аниона Сl- от АlСl-4:
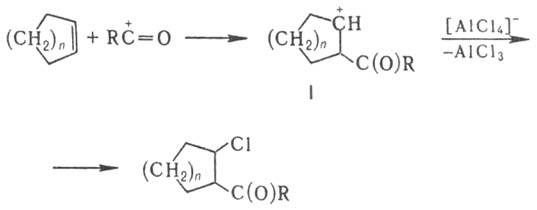
На заключит. стадии хлорсодержащий
кетон восстанавливается водородом в момент выделения.
Р-цию применяют в препаративных
целях. Она открыта К. Неницеску в 1934.
Лит.: Hanuise J.,
Smolders R., "Bull. Soc. Chim. France", 1967, fasc. 6, p. 2139-41.
2. Циклоконденсация 1,4-бензохинонов
с эфирами N-монозамещенных производных b-аминокротоновой к-ты с образованием
эфиров 5-гидроксииндол-3-карбоновых к-т:
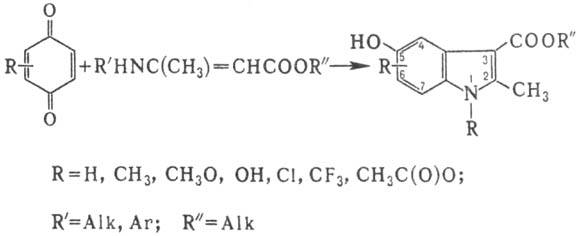
Р-цию обычно проводят в
кипящем этаноле, хлороформе или уксусной к-те в инертной атмосфере. Продукты
выделяют перекристаллизацией, возгонкой или с помощью зонной плавки. Выходы
индолов 20-75%.
Аналогично эфирам N-монозамещенных
производных b-аминокротоновой к-ты реагируют енамины общей ф-лы RNHC(R')=CHR:.
Замещенные хиноны дают смесь продуктов, содержащих в индольном цикле заместитель
в положениях 6 и 7. Соед. с заместителями в положении 4 образуются только из
хинонов с сильными электроноакцеп-торными заместителями [напр., ОС(О)СН3,
CF3]. При взаимод. бензохинонов с b-аминовинилкетонами образуются
3-ацил-5-гидроксииндолы.
При циклизации 1,4-бензохинонов
с эфирами N,N-диал-киламинокротоновой к-ты в условиях Н.р. образуются производные
дигидробензофурана, напр.:
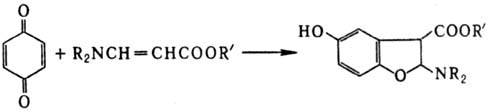
Р-цию используют в препаративных
целях. Она открыта К. Неницеску в 1929.
Лит.: Пакетт А.,
Основы современной химии гетероциклических соединений, пер. с англ., М., 1971,
с. 145; Littell R., Morton G. О., Alien G. R., "J. Amer. Chem. Soc.",
1970, v. 92, № 12, p. 3740-46; Sundberg R. J., The chemistry of indoles, N.Y.-L.,
1970, p. 171-76.
3. Получение индолов восстановит.
циклизацией 2,b-ди-нитростиролов:
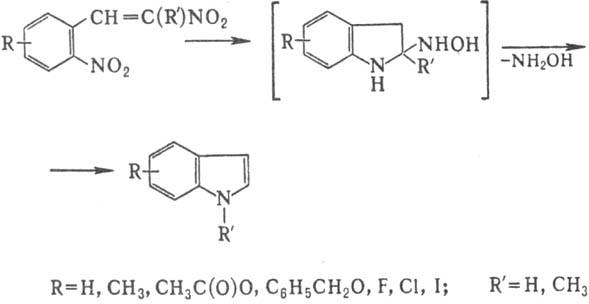
Обычно р-цию проводят при
нагр., добавляя динитростирол к смеси уксусной к-ты и железных стружек (можно
также использовать кат. Pd/C в смеси этанол-уксусная к-та). Конечный продукт
выделяют фракционированием или перекристаллизацией. Выходы индолов 20-85% (при
использовании кат. Pd/C выходы возрастают).
Р-цию применяют в препаративных
целях. Она открыта К. Неницеску в 1925.
Лит.: Sundberg R.,
The chemistry of indoles, N.Y.-L., 1970, p. 182-83; Eiden F., Kucklander U.,
"Arch. Pharm.", 1973, Bd 306, № 6, S. 446-49.
Г. И. Дрозд.


