НЕЙРАМИНИДАЗА (сиалидаза,
ацилнейраминазил-гидро-лаза), фермент класса гидролаз, катализирующий гидролиз
a-кетозидной связи между остатком N-ацетилнейраминовой к-ты и соседним моносахаридом
в олигосахаридах, глико-протеинах или гликолипидах, напр.:
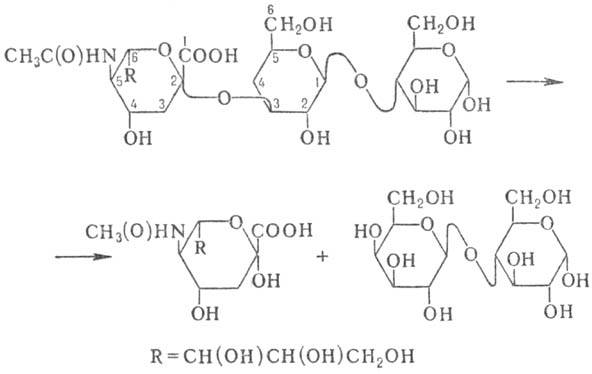
Н. широко распространена
в природе, она входит в состав оболочек нек-рых вирусов; обнаружена в ряде патогенных
микроорганизмов (впервые Н. была открыта в культуре возбудителей газовой гангрены
Clostridium perfringens), a также у позвоночных и беспозвоночных животных. У
растений Н. не обнаружена.
Фермент строго специфичен
по отношению к конфигурации кетозидной связи и относительно специфичен к положению
этой связи в молекуле. Н. из холерного вибриона и возбудителя газовой гангрены,
обычно применяющиеся в лаб. практике, могут расщеплять a-2 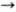 3-
и a-2
3-
и a-2 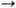 6-кето-зидные связи. Вирусные Н., как правило, обладают более строгой специфичностью
по отношению к положению а-кетозидной связи. Фермент не требует кофакторов,
но нек-рые из Н. активируются ионами Са2+ .
6-кето-зидные связи. Вирусные Н., как правило, обладают более строгой специфичностью
по отношению к положению а-кетозидной связи. Фермент не требует кофакторов,
но нек-рые из Н. активируются ионами Са2+ .
Н. из мн. источников выделены
и очищены до индивидуального состояния. Н. из вирусов гриппа состоит из четырех
идентичных субъединиц с мол. м. ок. 33,5 тыс. Для этого фермента идентифицированы
антигенные детерминанты и их расположение в молекуле. Оптимальная каталитич.
активность фермента в зависимости от источника проявляется при разных значениях
рН (обычно при рН 3,5-7).
Н. играет важную роль в
организме животных, ее отсутствие приводит к тяжелым заболеваниям-сиалидозам.
Фермент широко применяют в лаб. практике, для установления структуры углеводных
цепей.
Лит.: Химия углеводов,
М., 1967, с. 602-21; Видершайн Г. И., Биохимические основы гликозидозов, М.,
1980; Gottschalk A., Drzeniek К., в кн.: Glycoproteins. Their composition, structure
and function, 2 ed., pt A, Amst.- L- N. Y., 1972,
p. 381 -402; Cell biology monographs; sialic acids, ed. by R. Schauer, v. 10,
N. Y., 1982. Н.Д. Габриэлян.


