НАТРИЯ СУПЕРОКСИД (гипероксид
натрия, надпероксид натрия) NaO2, желтые кристаллы; выше — 50 °С
устойчива фаза I кубич. сингонии (а = 0,549 нм, z = 4, пространств.
группа Рт3т), в интервале от —50 до — 77 °С- кубич. фаза II
(а = 0,546 нм, пространств. группа Ра3), в интервале от
— 77 до - 230 °С-ромбич. фаза III (при -100°С а = 0,426 нм, b
= 0,554 нм, с = 0,334 нм, пространств. группа Рппт), ниже
— 230 °С-фаза IV; плотн. 2,21 г/см3; С0р
71,88 ДжДмоль•К); DH0обр - 261 кДж/моль, DG0обр
— 219 к Дж/моль. При непрерывном нагревании со скоростью 5 град/мин термич.
распад NaO2 начинается ок. 100 °С, осн. часть кислорода выделяется
при 240-300 °С, твердый продукт распада - пероксид Na2O2;
дефектность кристаллов Н.с. влияет на скорость его распада.
Н.с. раств. в жидком NH3
(~0,5 г в 100 мл), при -32,5°С из р-ра выпадает аммиакат NaO2.2NH3.
Растворение NaO2 в воде сопровождается выделением О2 и
образованием щелочного р-ра Н2О2:
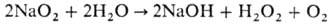
В присут. катализатора,
напр. МnО2, или при нагр. р-ция с водой идет по схеме:
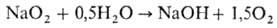
Н. с.-активный окислитель;
при комнатной т-ре в присут. паров воды с SO2 образует Na2SO4,
с NO2-NaNO3; при 100-180 °С поглощает СО, давая Na2CO3.
В присут. паров воды при комнатной т-ре СО2 полностью вытесняет активный
кислород из NaO2, при этом образуется Na2CO3,
в отсутствие влаги эта р-ция идет лишь выше 100°С.
Пром. способ получения
Н.с. состоит в медленном нагревании Na2O2 от 200 до 450
°С в автоклаве при давлении О2 10-15 МПа. Н.с. может быть также
получен окислением О2 металлич. Na в среде 1,2-димeтоксиэтана в присут.
флуорена или бензофенона при обычных условиях. Н.с.-компонент систем для регенерации
кислорода в замкнутых помещениях. В. Я. Росоловский.


