НАТРИЯ ПЕРОКСИД Na2O2,
бесцв. кристаллы, техн. Н.п. слабо-желтого цвета из-за примеси NaO2.
До 512°С существует b-Na2O2 с гексагон. кристаллич.
решеткой (а= 0,6208 нм, с = 0,4469 нм, z = 3, пространств.
группа Р62т), выше 512°С устойчив a-Na2O2,
DH перехода a<=>b 5,36 кДж/моль; плотн. 2,61 г/см3;
C0p 89 ДжДмоль•К); DH0пл
17кДж/моль, DH0обр -512 кДж/моль; S0298
94 ДжДмоль• К). Н.п. начинает терять кислород при 311-400 °С, бурно
разлагается при 540 °С. Раств. в воде с образованием NaOH, H2O2
и О2. Образует кристаллогидраты Na2O2.nH2O,
где п = 2,4,8, Na2O2.2H2O2.4H2O.
С влагой воздуха и СО2 реагирует, давая NaOH, Na2CO3
и О2, с N2O4 при 20°C-NaN03,
с NO-NaNO2, с SO2-Na2SO4. Н.п.-
сильный окислитель.
Получают Н.п. окислением
расплавл. Na кислородом воздуха, очищенного от СО2 и высушенного.
Применяют Н. п. для регенерации воздуха (Na2O2 + CO2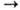 Na2CO3
+ + 1/2О2) в подводных лодках и дыхат. приборах изолирующего типа,
водные р-ры-для отбеливания бумаги, тканей, целлюлозы; в аналит. химии-для перевода
тугоплавких оксидов в растворимое состояние путем сплавления с Н. п.
Na2CO3
+ + 1/2О2) в подводных лодках и дыхат. приборах изолирующего типа,
водные р-ры-для отбеливания бумаги, тканей, целлюлозы; в аналит. химии-для перевода
тугоплавких оксидов в растворимое состояние путем сплавления с Н. п.
Н. п. огнеопасен в присут.
орг. в-в.
Лит.: Вольное И.
И., Пероксидные соединения щелочных металлов, М., 1980.
Е.В. Савинкипа.


