НАПРЯЖЕНИЕ МОЛЕКУЛ, мера
неустойчивости хим. соединения, к-рая количественно выражается его избыточной
энергией по сравнению с эталонным (стандартным) соед., обладающим миним. энергией
в ряду сходных в-в. Н.м. создается отклонением разл. структурных параметров
от идеальных (стандартных) значений, свойственных молекуле эталонного соединения.
Обычно рассматривают длины связей, валентные углы, углы внутр. вращения и расстояния
между валентно не связанными атомами. В качестве эталонных выбирают молекулы,
к-рые имеют длины связей, равные суммам ковалентных радиусов атомов; валентные
углы, соответствующие углам между осями орбиталей при данной гибридизации атома
(Сspз 109° 28', Сsр2 120°,
Csp 180°); заторможенные конформации по всем связям и
не имеют неблагоприятных близких контактов между валентно не связанными атомами.
Э н е р г и я н а п р я
ж е н и я вычисляется как разность экспериментально определенных энтальпий образования
исследуемого в-ва и стандарта. В ряде случаев энергия последнего м.б. вычислена
как аддитивная сумма инкрементов групп, напр. для алканов инкремент группы СН3
42,2 кДж/моль, СН2 21,5 кДж/моль, СН 9,1 кДж/моль, С 1,3 кДж/моль.
Существование стабильной, т.е. отвечающей минимуму на пов-сти потенц. энергии,
напряженной мол. структуры обусловливается замыканием цикла или накоплением
близко расположенных объемистых заместителей. Б.ч. имеет место искажение идеальной
структуры, затрагивающее ряд геом. параметров. При этом происходит частичная
компенсация напряжений в одном из фрагментов за счет искажения геометрии другого,
так что реальная структура молекулы отвечает минимуму суммарной энергии. Количеств.
оценка м.б. произведена методом молекулярной механики: подсчитывается
сумма вкладов энергий растяжения или сжатия связей, искажения углов-валентных
и внутр. вращения, взаимод. валентно не связанных атомов.
Растяжение связей наблюдается
в полициклич. молекулах, а также при накоплении объемистых заместителей у образующих
связь атомов. Напр., длина связи Сsрз—Сsрз
увеличена по сравнению со стандартной величиной 0,1534 нм до 0,1582 нм в гексаметилэтане,
0,1606 нм в пентафенилэтане, 0,1611 нм в три-трет-бутилметане. Очень
сильное растяжение связи С=С имеет место в циклобутене (0,1566 нм).
Энергия углового напряжения
обычно обеспечивает макс, вклад в Н.м. благодаря большим интервалам изменения
валентных углов. Угловое напряжение наз. иногда байеров-ским по имени А. Байера,
к-рый в 1885 предложил т.наз. теорию напряжения, объясняющую зависимость св-в
циклов от их размера, в частности легкость разрыва малых циклов. Для насыщ.
циклов энергия байеровского напряжения пропорциональна квадрату отклонения от
тетраэдрич. значения внутр. угла правильного многоугольника, соответствующего
плоской структуре цикла: в циклопропане отклонение 49°28' (следует, однако,
учитывать твердо установленную в настоящее время изогнутость связей трехчленного
цикла), в циклобутане 19°28', в циклопентане 1028'. Начиная с
цикло-гексана возможно образование неплоских циклов с ненапряженными валентными
углами. Этому соответствуют энергии напряжения малых циклов относительно цикло-гексана,
равные в расчете на одну связь С—С для 3-, 4- и 5-членного циклов соотв. 37,7,
26,4 и 5,0 кДж/моль. В циклах больших размеров угловое напряжение проявляется
при наличии тройной
связи: циклоалкины с размером кольца меньше 8-членного не существуют, а в циклооктине
угол С==С—С равен 158,5° вместо нормального 180°. В аналогичных циклоалкенах
двойная связь создает напряжение при E-конфигурации, так что избыточная
энергия транс-циклооктена по сравнению с цис-изомером составляет
52,9 кДж/моль. Особенно велики байеровские напряжения ненасыщ. малых циклов-энергии
их для циклопропена и циклобутена составляют соотв. 232 и 119 кДж/моль. Требования
углового напряжения обусловливают ряд структурных запретов, в т.ч. Бредта
правило.
Торсионное напряжение,
обусловленное вынужденным отклонением от наиб. выгодной конформации, носит иногда
назв. питцеровского, поскольку К. Питцер в 1936 впервые рассмотрел изменение
энергии при внутр. вращении в этане. Особенно сильное напряжение вызывается
выводом из ко-планарности заместителей при двойной связи, для к-рой барьер вращения
составляет ок. 250 кДж/моль. Наглядным примером проявления торсионного напряжения
является теплота гидрогенизации циклопентена в циклопентан, на 8,1 кДж/моль
меньшая, чем в случае 6-членных аналогов, несмотря на большее угловое напряжение
в циклопентене. Причина в том, что в почти плоской молекуле циклопентана невыгодны
заслоненные конформации пяти связей С—С.
Взаимод. между валентно
не связанными атомами (не-связевое, ван-дер-ваальсово) складывается из отталкива-тельной
и аттрактивной составляющих. Энергия его описывается двухчленными или более
сложными ф-циями расстояний между взаимодействующими атомами (см. Межмолекулярные
взаимодействия). Проявляются несвязевые взаимод., если эти расстояния существенно
меньше сумм ван-дер-ваальсовых радиусов атомов. Частным случаем является т.наз.
прелоговское напряжение средних циклов (по имени В. Прелога, к-рый описал его
в 1950 как "неклассическое" напряжение циклов). Для циклоалканов
С8, С9, С10 и С11 избыточная энергия
на одну связь С—С по отношению к циклогексану составляет соотв. 5,1; 5,9; 5,0
и 4,2 кДж/моль. В 10-членном цикле отмечается также миним. теплота гидрогенизации
циклоалкена в циклоалкан. Эти факты обусловлены тем, что в наиб. устойчивых
конформациях циклов средних размеров ряд атомов Н расположен внутри цикла и
между ними возникают близкие контакты (0,18 нм при сумме ван-дер-ваальсовых
радиусов 0,22 нм), заметно дестабилизирующие циклоалканы, особенно 9- и 10-членные.
Нек-рый вклад в прелоговское напряжение вносит также искажение торсионных углов.
Основные типы напряженных
молекул. Нек-рые ряды соед. с явными признаками напряжения рассмотрены выше
в качестве примеров для иллюстрации осн. типов взаимодействия. Однако в наиб.
напряженных структурах проявляются обычно разл. виды напряжения одновременно.
В малых циклах связи С—С имеют заслоненные или близкие к ним конформации, так
что торсионное напряжение накладывается на угловое. Влияние их на структуру
молекулы различно. Молекула циклобутана неплоская, что увеличивает байеровское
напряжение, но уменьшает торсионный вклад. То же имеет место для циклопентана.
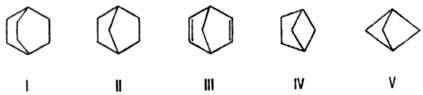
Наиб. характерные напряженные
молекулы -би- и полициклические. Структуры типа бициклооктана (ф-ла I) дестабилизируются
заслоненными конформациями мостиковых групп; для этого соед. энергия напряжения
Ен 31,1 кДж/моль. Напряжение в норборнане (II) усиливается
за счет очень малого валентного угла ССС метиленового мостика (93,2°), и
величина Ен по сравнению с соед. I увеличивается вдвое (60,5
кДж/моль). Еще меньше мостиковый угол в норбор-надиене (III). Соотв. удлинены
связи С—С в метиленовом мостике
до 0,1560 нм в соед. II и 0,1573 нм в соед. III. По мере уменьшения длины мостиков
Н.м. возрастает, достигая в бициклогексане (IV) 155 кДж/моль, а в бицикло-пентане
(V) 286 кДж/моль.
Значительно усиливается
Н.м. в конденсированных малых циклах. Бициклобутан (VI) имеет Ен
270 кДж/моль, бициклопентан (VII) 230 кДж/моль. Для соед. VII отмечаются
макс. энергии гидрогенизации до циклопентана и изомеризации в циклопентен. Общее
напряжение вызывает удлинение связи С-2—С-3 до 0,1622 нм.
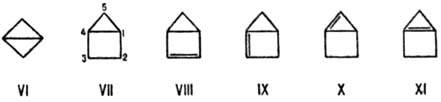
Поскольку стандартные валентные
углы олефинового атома углерода больше тетраэдрических, Н.м. возрастает в бицикленах.
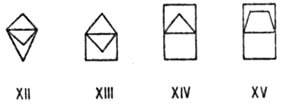
Напр., для изомерных бициклобутенов (VIII-XI) энергия напряжения составляет
соотв. 285, 512, 504 и 529 кДж/моль. Почти таково же Н.м. в пропелланах с малыми
циклами: для соед. XII-XV величины Ен находятся в интервале
от 378 до 441 кДж/моль.
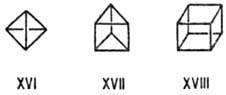
Еще более напряжены полиэдрич.
(каркасные) молекулы-производные тетраэдрана (XVI), призмана (XVII), кубана
(XVIII) и др. В них очень велики вклады растяжения связей и сжатия валентных
углов, так что избыточные энергии достигают величин более 580 кДж/моль для соед.
XVI и 640 кДж/моль для соед. XVIII. Частичная компенсация достигается, согласно
теоретич. расчету, при концентрации электронного облака внутри мол. каркаса;
стабильность таких соед. увеличивается заместителями с s-донорными и p-акцепторными
св-вами, а также объемистыми радикалами. Поэтому наиб. устойчивы тетра-тирега-бутилтетра-эдран,
пертрифторметилыше производные призмана и кубана.
Н.м. в результате взаимод.
валентно не связанных атомов проявляется в соед. с большим числом близко расположенных
объемистых заместителей и в аналогичных случаях, к-рые обычно обозначаются как
внутримол. перегруженность. Часто она действует наряду с торсионным напряжением
в системах, содержащих заслоненные связи. Напр., цис-1,2-диметилциклопентан
(XIX, здесь и далее черточкой показана метильная группа) на 7,6 кДж/моль менее
стабилен, чем транс-изомер, вследствие взаимод. двух метильных групп.
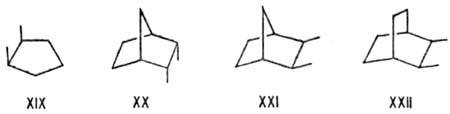
Неустойчивы мостиковые
системы с циc-вицинальным замещением. Соединения XX-XXII в равновесиях
с неперегруженными транс-изомерами содержатся в кол-вах соотв. 2,7 и
4%. Очень характерной стерически напряженной ситуацией является 1,3-параллельное
расположение связей, приводящее
к дестабилизации гош, гoш-конформаций типа XXIII, напр. в пентане, R
= СН3, на 15 кДж/моль. Частным случаем в циклогексановом ряду является
1,3-син-аксиоль-ное взаимод. (см. Конформационный анализ)в соед.
XXIV. Напряжены молекулы, для к-рых невозможны заторможенные конформации без
таких взаимод., напр. 2,2,4-триметил-пентан (XXV), 1,1,3,3-тетразамещенные циклогексаны
(XXVI), эндо,эндо-2,6-диметилнорборнан (XXVII), к-рый в равновесии
с др. изомерами содержится в кол-ве 1%.
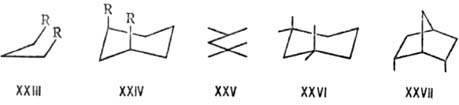
Аналогичные взаимод. приводят
к меньшей стабильности цис-1,2-дизамещенных этиленов по сравнению с траис-изо-мерами,
до величины 40 кДж/моль для пары ди-трет-бутилэтиленов. В стерически
перегруженных ароматич. соед. происходит отклонение заместителей в разные стороны
от плоскости кольца (в гексахлорбензоле на 12°) и нарушение планарности
конденсир. систем, как в дибензофенантрене (XXVIII): сближенные атомы углерода
расходятся до расстояния между ними 0,3 нм. В мостиковых молекулах типа 2,2-парациклофана
(XXIX) напряжение приводит к некопла-нарности связей, образуемых замещенными
ароматич. атомами С, и к выходу этих атомов из плоскостей остальных атомов бензольных
колец. Н.м. орто-замещенных бифени-лов (XXX) обусловливает их специфич.
конформац. поведение (т. наз. атропоизомерия, см. Изомерия).
Напряжение молекул и
реакционная способность. Концепция Н.м. широко используется при интерпретации
данных по положениям равновесия и скоростям р-ций. Соотношение напряжений исходных
в-в и продуктов р-ций во мн. определяет положение равновесия (предпочтительность
менее перегруженной формы). Если напряжение в переходном состоянии р-ции меньше,
чем в исходном реагенте, происходит ускорение процесса, и наоборот.
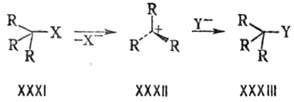
При анализе реакц. способности
часто используется классификация Н.м. на напряжения F-, В- и I-типа,
введенная в 50-х гг. 20 в. Г. Брауном при интерпретации равновесий комплексообразования
аминов с боранами. Прямое взаимод. валентно не связанных атомов со стороны реагирующей
неподеленной электронной пары атома N обозначается F (от англ. front).
B-Напряжение (от англ. back) обусловлено взаимод. между заместителями
у реакц. центра. Им объясняется, напр., повышенная скорость мономол. замещения
молекул с разветвленными алкильными заместителями, поскольку напряжение в плоском
промежуточном карбкатионе XXXII меньше, чем в тетраэдрич. исходной молекуле
XXXI и продукте XXXIII.
Специально для циклич.
систем предложено I-напряжение (от англ. inner, "внутреннее"),
обусловленное изменением координац. числа кольцевого атома, участвующего в р-ции.
Снижение байеровского напряжения
в продукте смещает равновесие р-ции в его сторону, а в переходном состоянии-повышает
скорость процесса. Напр., метилспциклопропан (XXXIV) легко присоединяет по двойной
связи:
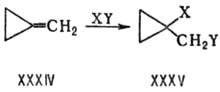
Поскольку внутр. угол трехчленного
цикла (60°) ближе к тетраэдрическому, стандартному для продукта XXXV, то
циклопропановая структура имеет меньшее напряжение (115 кДж/моль) по сравнению
с метиленциклопропановой (171 кДж/моль).
Лит.: Пространственные
эффекты в органической химии, под ред. М.С. Ньюмена, пер. с англ., М.,
1960; Вилков Л.В., Мастрюков B.C., Садова Н.И., Определение геометрического
строения свободных молекул. Л., 1978; Петров Ал. А., Стереохимия насыщенных
углеводородов, М., 1981; Дашезский В. Г., Конформационный анализ органических
молекул, М., 1982; М инк ин В. И., Миняев Р. М., Неклассические структуры органических
соединений, Ростов н/Д., 1985; Потапов В. М., Стереохимия, 2 изд., М., 1988;
Wiberg К.В., "Angew. Chem.", 1986, Bd 96, № 4, S. 312-22. A.H.
Верещагин.


