МОНОАМИНОКСИДАЗЫ [амин:
кислород - оксидоредук-тазы(дезаминирующие)(содержащие флавин), МАО], ферменты
класса оксидоредуктаз, катализирующие окислит. дезаминирование
алифатич. жирно-ароматич. и гетероцик-лич. моноаминов по схеме:
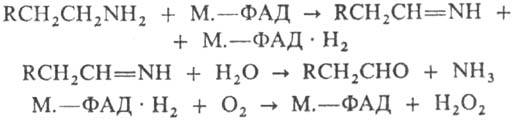
М.-моноаминооксидаза, ФАД
(флавинадениндинуклео-тид) - кофермент (см. Рибофлавин).
М.-гликопротеин, в углеводную
часть к-рого входят остатки сиаловой к-ты и гексозаминов. Молекула фермента
состоит из двух субъединиц (мол. масса каждой ок. 60 тыс.), на одной из к-рых
находится активный центр, содержащий ФАД. В состав активного центра входят также
остатки гистидина и по крайней мере 2 из 7-8 принадлежащих ферменту групп SH,
к-рые необходимы для проявления каталитич. активности. Величина рН, при к-рой
проявляется максю каталитич. активность, зависит от источника фермента и находится
в области 7,5-9,0; рI 4,7-5,3. Известны первичные структуры нек-рых М.
и созданы гипотетич. модели строения их активного центра.
Два осн. изофермента М.
(А и Б) различаются по аминокислотному составу, мол. массе субъединиц (примерно
на 3 тыс.), чувствительности к ингибиторам и по субстратной специфичности. Наиб.
специфич. ингибитор М. A-N-3-(2,4-дихлорфенокси)пропил-N-метил-2-пропиниламин
(хлоргилин); М.Б избирательно ингибируется М-(1-метил-2-фенилэтил)-N-метил-2-пропиниламином
(депренилом). Эти ингибиторы необратимо алкилируют ФАД. Специфичность обоих
ингибиторов проявляется только в низких концентрациях. Существуют также ингибиторы
др. строения и механизма действия, напр. производные гидразина (см. Антидепрессанты).
Специфич. субстраты М. А-серотонин и норадрена-лин, М. Б-2-фенилэтиламин
и бензиламин. Обе формы М. одинаково хорошо окисляют тирамин [2-(4-гидроксифенил)-этиламин].
М. содержится гл. обр.
в печени, почках, мозге, тромбоцитах и плаценте млекопитающих, в печени и мозге
рыб, а также в нек-рых бактериях, напр. в кокках Sarcina luteae. Обычно фермент
расположен в мембранах митохондрий в комплексе с фосфолипидами, в нек-рых клетках
М. находится в мембранах эндоплазматич. ретикулума и в цитоплазме. Считается,
что М. защищает организмы от воздействий биогенных аминов путем их инактивации
и регулирует содержание серотонина и норадреналина в нервной ткани. Мн. продукты
р-ций, катализируемых М., также обладают биол. активностью и способны оказывать
специфич. воздействие на обмен в-в.
Активность М. чаще всего
определяют с помощью аминов, меченных 14С, анализируя образование
меченых альдегидов, избирательно экстрагируемых нек-рыми орг. р-рите-лями; применяют
также методы, основанные на определении NH3 и Н2О2.
В пром-сти иммобилизованные
М. используют в тир-амин-чувствит. электродах, предназначенных для контроля
свежести мяса.
Лит.: Горкин В.З.,
Аминоксидазы и их значение в медицине, М., 1981; Monoamine oxtidase. Basic and
clinical frontiers, ed. by K. Kamijo, E. Usdin, T. Nagatsu, Amst.-Oxf.-Princeton,
1982; Structure and functions of amine oxidases, ed. by B. Mondovi, Florida,
1985. B.A. Пеккель.


