МАРГАНЦА СУЛЬФАТ MnSO4, имеет т. пл. 700°С; С°р 100,24 Дж/(моль.К); DG0обр -958,11 кДж/моль; ниже 11 К (точка Нееля) антифсрромагнетик, выше 11 К парамагнетик, магн. восприимчивость + 1,366.10-6 (293 К); см. также табл. Ок. 850°С разлагается на Mn3O4, SO3 и SO2.
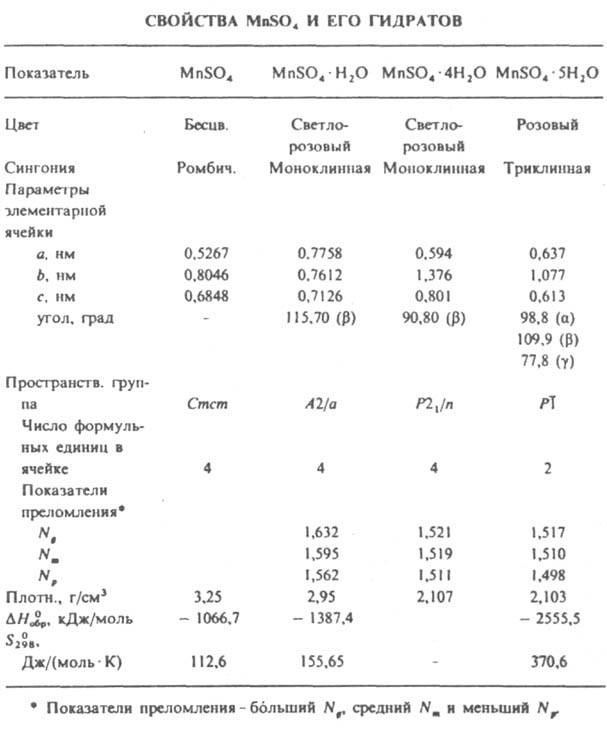
Р-римость в воде (г в 100 г): 52,9 (0°C), 64,8 (25 °C), 35,5 (100°С), 20,5 (120°С), 3,9 (160°С). Известны гидраты М.с. с 1, 2, 4, 5 и 7 молекулами воды. Моногидрат MnSO4.H2O образуется при нагр. др. гидратов М.с. до ~ 200°С, выпадает из водных р-ров при 150-160 °С Дигидрат МnSO4.2Н2О (плотн. 2,526 г/см3) и тетрагидрат MnSO4.4Н2О метастабильны. Дигидрат выпадает из водных р-ров при 25-40 °С, тетрагидрат - при 26-27 °С. Пентагидрат MnSO4.5H2O имеет т. пл. 55 °С (инконгруэнтно). Гептагидрат MnSO4.7H2O - розовые кристаллы; т. пл. 8,6 °С (инконгруэнтно); плотн. 2,09 г/см3; DH0обр -3136,3 кДж/моль; устойчив ниже 8,6°С; М.с. образует аммиакат с шестью, а моногидрат с пятью молекулами NH3. Известны двойные сульфаты MI2SO4.MnSO4, а также их ди-, тетра- и гексагидраты. М.с. встречается в природе в виде минералов смикита MnSO4.H2O, маллардита MnSO4.7H2O, джококуита MnSO4.5H2O, илезита MnSO4.4H2O. Получают М.с.: обработкой пиролюзита MnО2 горячей конц. H2SO4; растворением Mn и MnО в H2SO4; прокаливанием пиролюзита с безводным FeSO4; безводный М.с. - нагреванием его гидратов до 280°С. М.с. - промежут. продукт при переработке марганцевых руд и шламов. Его применяют для синтеза др. соед. Mn, как компонент электролита при получении MnО2 и Mn, компонент красителей в текстильной пром-сти, катализатор в орг. синтезе, микроудобрение. Известен сульфат марганца(III) Mn2(SO4)3 - зеленое аморфное или кристаллич. в-во; малоустойчив, разлагается при 160°С; гидролизуется водой, раств. в H2SO4; сильный окислитель; получают растворением Mn2О3 в холодной H2SO4 с послед. небольшим нагреванием. Известны также Mn2(SO4)3.H2SO4.4H2O, двойные соли MIMn(SO4)2, МIMn(SO4)2.12Н2О, где МI - Rb, Cs и нек-рые др. металлы. М.с. токсичны; для аэрозолей ПДК 0,3 мг/м3 (в пересчете на MnО2). Лит.: Позин М. Е., Технология минеральных солей, 4 изд., ч. 1, М., 1974, с. 775-77. И. Н. Один.

Р-римость в воде (г в 100 г): 52,9 (0°C), 64,8 (25 °C), 35,5 (100°С), 20,5 (120°С), 3,9 (160°С). Известны гидраты М.с. с 1, 2, 4, 5 и 7 молекулами воды. Моногидрат MnSO4.H2O образуется при нагр. др. гидратов М.с. до ~ 200°С, выпадает из водных р-ров при 150-160 °С Дигидрат МnSO4.2Н2О (плотн. 2,526 г/см3) и тетрагидрат MnSO4.4Н2О метастабильны. Дигидрат выпадает из водных р-ров при 25-40 °С, тетрагидрат - при 26-27 °С. Пентагидрат MnSO4.5H2O имеет т. пл. 55 °С (инконгруэнтно). Гептагидрат MnSO4.7H2O - розовые кристаллы; т. пл. 8,6 °С (инконгруэнтно); плотн. 2,09 г/см3; DH0обр -3136,3 кДж/моль; устойчив ниже 8,6°С; М.с. образует аммиакат с шестью, а моногидрат с пятью молекулами NH3. Известны двойные сульфаты MI2SO4.MnSO4, а также их ди-, тетра- и гексагидраты. М.с. встречается в природе в виде минералов смикита MnSO4.H2O, маллардита MnSO4.7H2O, джококуита MnSO4.5H2O, илезита MnSO4.4H2O. Получают М.с.: обработкой пиролюзита MnО2 горячей конц. H2SO4; растворением Mn и MnО в H2SO4; прокаливанием пиролюзита с безводным FeSO4; безводный М.с. - нагреванием его гидратов до 280°С. М.с. - промежут. продукт при переработке марганцевых руд и шламов. Его применяют для синтеза др. соед. Mn, как компонент электролита при получении MnО2 и Mn, компонент красителей в текстильной пром-сти, катализатор в орг. синтезе, микроудобрение. Известен сульфат марганца(III) Mn2(SO4)3 - зеленое аморфное или кристаллич. в-во; малоустойчив, разлагается при 160°С; гидролизуется водой, раств. в H2SO4; сильный окислитель; получают растворением Mn2О3 в холодной H2SO4 с послед. небольшим нагреванием. Известны также Mn2(SO4)3.H2SO4.4H2O, двойные соли MIMn(SO4)2, МIMn(SO4)2.12Н2О, где МI - Rb, Cs и нек-рые др. металлы. М.с. токсичны; для аэрозолей ПДК 0,3 мг/м3 (в пересчете на MnО2). Лит.: Позин М. Е., Технология минеральных солей, 4 изд., ч. 1, М., 1974, с. 775-77. И. Н. Один.


