СН2ОН(СНОН)nСН2ОН + (п + 1)НIO4 : 2НСНО + пНСООН + (п + 1)НIO3 + Н2О;
СН2(ОН)СНО + НIO4 : НСНО + НСООН + НIO3;
СН3СН(ОН)СН2ОН + НIO4 : СН3СНО + НСНО + НIO3 + Н2O;
СН3СОСОСН3 + Н5IO6 : 2СН3СООН + НIO3 + Н2О
Одноатомные спирты, кетоны и альдегиды в условиях М. р. не окисляются. М. р. проводят при комнатной т-ре или при охлаждении в слабокислых, нейтральных или слабощелочных водных и водно-орг. р-рах. Окисление диолов происходит по схеме:
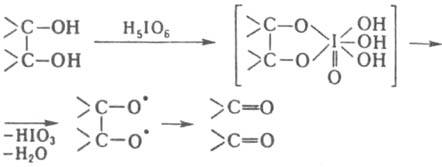
Скорость окисления зависит от рН среды, структуры и геом. конфигурации соединений. Так, цис-изомеры производных пираноз окисляются значительно быстрее, чем mpaнc-изомеры.
Аналит. контроль М. р. осуществляется по определению не вошедшего в р-цию избытка IO4-, а также прямым определением продуктов р-ции - иодата, альдегидов и к-т (чаще формальдегида и муравьиной к-ты). По этим данным можно получить информацию о числе первичных и вторичных вицинальных спиртовых групп и о кол-ве расщепленных С—С-связей окисленного полиола. Это позволяет применять М. р. не только для количеств. определения многоатомных спиртов, в т. ч. диолов и полиолов при их совместном присутствии (т. к. при окислении диолов в отличие от полиолов образуются только альдегиды), но и для установления строения углеводов, многоатомных спиртов, стероидов и их производных.
Р-ция открыта Л. Малапрадом в 1928 при окислении a-диолов.
Лит.: Берка А., Вултерин Я., Зыка Я., Новые редокс-методы в аналитической химии, пер. с чеш., М., 1968, с. 114-27; Захаранс В. Я., "Изв. АН Латв. ССР, сер. хим. н.", 1982, № 1, с. 3-18. Р. А. Дубинский.


