ЛИЗОЦИМ (мурамидаза), фермент класса гидролаз, катализирующий гидролиз b-1 : 4-гликозидной связи между остатками N-ацетилглюкозамина и N-ацетилмураминовой к-ты (см. ф-лу) пептидогликана клеточной стенки бактерий. Гидролизует также такую же связь в полимере, состоящем из остатков N-ацетилглюкозамина (хитине), но со значительно меньшей скоростью.
Л. обнаружен практически во всех организмах. У позвоночных содержится гл. обр. в слезах, слюне, селезенке, легких, почках и лейкоцитах; в тканях локализуется в лизосомах.
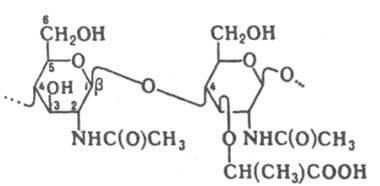
Выделено и изучено более 50 Л. из разных источников. Все они состоят из одной полипептидной цепи и являются сильно основными белками (рI 10,5-11). Hаиб. изучен Л. белка куриных яиц (мол. м. 14306). Полностью определено его строение, в т.ч. третичная структура. Молекула Л. имеет форму, близкую к форме эллипсоида с осями 3,0 и 4,5 нм. Ее пересекает косая щель, в к-рой происходит сорбция и гидролиз субстрата (в ней м. б. связано 6 гликопиранозных звеньев). Щель имеет гидрофобный карман, в к-ром локализуется ацетамидная группа N-ацетилглюкозамина. Важную роль в механизме гидролиза гликозидной связи играют группа С(О)О- остатка аспарагиновой к-ты (поляризует связь) и недиссоциированный карбоксил остатка глутаминовой к-ты (донор протона). Оптим. условия для лизиса (разрушения) микробов Microccocus lysodeikticus (обычного тест-субстрата Л.) - рН 6-7, ионная сила р-ра 0,1. Ионы Сl-несколько активируют Л.; в отсутствие солей его активность резко падает. Повышение т-ры вплоть до 60 °С увеличивает активность Л.; дальнейшее нагревание обратимо инактивирует фермент. В р-ре (особенно в кислой среде при рН 2-3) Л. выдерживает без необратимой денатурации кратковременное кипячение. В сухом виде фермент выдерживает нагревание при 160°С в течение 1 ч. Конкурентные ингибиторы Л. - близкие по строению к субстрату олигосахариды с небольшим числом звеньев или моносахариды, напр. N-ацетилглюкозамин и олигомер, содержащий 2 или 3 его остатка. У позвоночных Л. выполняет ф-ции неспецифич. антибактериального барьера. Механизм действия обусловлен способностью фермента нарушать клеточную стенку бактерий и вызывать их лизис. Л. применяют в медицине как противомикробное ср-во (в т.ч. как добавка в продукты питания для детей). Лит.: Бухарин О. В., Васильев Н. В., Лизоцим и его роль в биологии и медицине, Томск, 1974; Основы биохимии, пер. с англ., т. I, M., 1981, с. 313-17; Lisozyme, ed. by E. F. Osserman, R. E, Canfield, S. Beychok, N.Y., 1974; Jolles P., Jolles J., "Molec. and Cell Biochem.", 1984, v. 63, № 2, p. 165-89. Н. А. Кравченко.

Выделено и изучено более 50 Л. из разных источников. Все они состоят из одной полипептидной цепи и являются сильно основными белками (рI 10,5-11). Hаиб. изучен Л. белка куриных яиц (мол. м. 14306). Полностью определено его строение, в т.ч. третичная структура. Молекула Л. имеет форму, близкую к форме эллипсоида с осями 3,0 и 4,5 нм. Ее пересекает косая щель, в к-рой происходит сорбция и гидролиз субстрата (в ней м. б. связано 6 гликопиранозных звеньев). Щель имеет гидрофобный карман, в к-ром локализуется ацетамидная группа N-ацетилглюкозамина. Важную роль в механизме гидролиза гликозидной связи играют группа С(О)О- остатка аспарагиновой к-ты (поляризует связь) и недиссоциированный карбоксил остатка глутаминовой к-ты (донор протона). Оптим. условия для лизиса (разрушения) микробов Microccocus lysodeikticus (обычного тест-субстрата Л.) - рН 6-7, ионная сила р-ра 0,1. Ионы Сl-несколько активируют Л.; в отсутствие солей его активность резко падает. Повышение т-ры вплоть до 60 °С увеличивает активность Л.; дальнейшее нагревание обратимо инактивирует фермент. В р-ре (особенно в кислой среде при рН 2-3) Л. выдерживает без необратимой денатурации кратковременное кипячение. В сухом виде фермент выдерживает нагревание при 160°С в течение 1 ч. Конкурентные ингибиторы Л. - близкие по строению к субстрату олигосахариды с небольшим числом звеньев или моносахариды, напр. N-ацетилглюкозамин и олигомер, содержащий 2 или 3 его остатка. У позвоночных Л. выполняет ф-ции неспецифич. антибактериального барьера. Механизм действия обусловлен способностью фермента нарушать клеточную стенку бактерий и вызывать их лизис. Л. применяют в медицине как противомикробное ср-во (в т.ч. как добавка в продукты питания для детей). Лит.: Бухарин О. В., Васильев Н. В., Лизоцим и его роль в биологии и медицине, Томск, 1974; Основы биохимии, пер. с англ., т. I, M., 1981, с. 313-17; Lisozyme, ed. by E. F. Osserman, R. E, Canfield, S. Beychok, N.Y., 1974; Jolles P., Jolles J., "Molec. and Cell Biochem.", 1984, v. 63, № 2, p. 165-89. Н. А. Кравченко.


