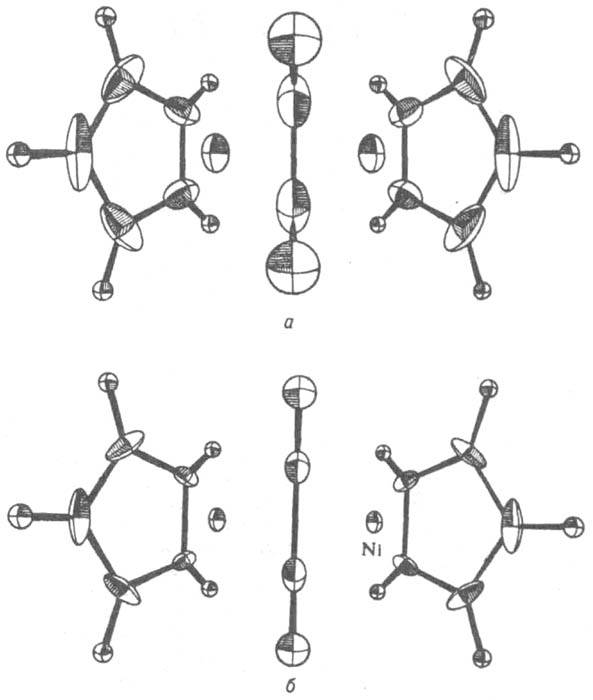
Рис. 1. Эллипсоиды тепловых колебаний атомов в сгрукгуре m-ацетилен-бис(циклопентадиенникеля) при 300 К (а) и 77 К (6). В центре молекула ацетилена, по бокам - молекулы циклопентадиена.
сортов (напр., анионы образуют упаковку, катионы располагаются в ее пустотах).
Учет трехмерного распределения электронной плотности р в пространстве декартовых координат х, у, z приводит к модели К. с., согласно к-рой атомные ядра "погружены" в непрерывно распределенный с плотностью р электронный заряд. Совр. прецизионный рентгеноструктурный анализ позволяет экспериментально изучать особенности ф-ции r(х, у, z) и определять изменение электронной плотности атомов в кристалле в сравнении с электронной плотностью r0 валентно не связанных атомов, получаемой в результате квантовохим. расчетов. Эти данные м. б. полезны для установления областей локализации валентных и неподеленных электронных пар, для обнаружения переноса заряда и др. особенностей строения в-в с ковалентными связями, а также в-в, в к-рых направленные межатомные взаимод. отсутствуют.
Для отражения динамики атомов в К. с. в гармонич. приближении атомы изображают в виде "тепловых эллипсоидов", к-рые имеют след. физ. смысл: с фиксир. вероятностью р в любой момент времени атомное ядро находится внутри или на пов-сти такого эллипсоида (рис. 1). Направление наиб. вытянутости эллипсоида соответствует направлению, в к-ром атом совершает максимальные по амплитуде колебания, направление наиб. сжатия соответствует минимальным по размаху колебаниям. Обычно производят нормировку на вероятность р=1/2. При данной р размеры эллипсоидов зависят от т-ры. Чтобы количественно охарактеризовать форму и ориентацию атомных тепловых эллипсоидов, для каждого атома указывают 6 независимых компонентов симметричного тензора 2-го ранга, значения к-рых определяют по данным рентгеноструктурного исследования. Описанная динамич. модель не дает сведений о мгновенной структуре кристалла и о последоват. смене мгновенных структур. Информацию такого рода можно получить из спектров неупругого рассеяния нейтронов.
Классификация К. с. В принципе каждому кристаллич. в-ву присуща своя структура. Однако часто разные в-ва имеют К. с., одинаковые с точностью до подобия (т. наз. изоструктурность). Иногда такие в-ва способны образовывать смешанные кристаллы (см. Изоморфизм). С др. стороны, одно и то же хим. соед. в разных термодинамич. условиях и при разных способах получения может иметь разные К. с. (см. Полиморфизм). К. с. очень многообразны - от простых (напр., у алмаза) до чрезвычайно сложных (напр., у бора). Изучены К. с. неск. десятков тысяч в-в, включая белки и др. сложные прир. соед. Для неск. сотен кристаллич. в-в (как неорг., так и орг.) изучено распределение электронной плотности в кристаллах.
К. с. делят нагомодесмические (координационные) и гетеродесмические. В первых все атомы соединены одинаковыми хим. связями, образующими пространств. каркас (напр., алмаз, галогениды щелочных металлов). Для вторых характерно наличие структурных фрагментов, внутри к-рых атомы соединены наиб. прочными (чаще всего ковалентными) связями; атомы, принадлежащие разл. фрагментам, связаны существенно слабее. Фрагменты могут представлять собой конечные группировки атомов ("острова"), цепи, слои, каркасы; соотв. выделяют островные, цепочечные, слоистые и каркасные К. с. Островными К. с. обладают почти все орг. соед., а также галогены, О2, S, (NH4)2SO4 и др. Роль островов играют молекулы (см. Молекулярные кристаллы) или многоатомные ионы. Цепочечную К. с. имеет, напр., одна из модификаций Se, в к-рой атомы связаны в бесконечные спирали. Слоистое строение имеют графит, BN, MoS2 и др. Пример каркасной К.с. - кристаллы СаТiO3: атомы Ti и О, соединенные ковалентными связями, образуют ажурный каркас, в полостях к-рого расположены атомы Са. Известны К. с., в к-рых сосуществуют структурные фрагменты разных типов. Так, кристаллы комплексного соед. N(CH3)4[MnCl3] построены из "островов" - ионов N(CH3)4 и цепей, образованных атомами Мn, связанными мостиковыми атомами Cl.
Часто встречаются К. с. с неполной упорядоченностью, в к-рых отдельные атомы или структурные фрагменты статистически занимают неск. возможных положений (напр., статистич. наложение слоев в CdI2). В нек-рых К. с. при достаточно высокой т-ре отдельные группы атомов или даже целые молекулы находятся в состоянии почти свободного или заторможенного вращения.
По характеру связи между атомами или структурными фрагментами различают ковалентные кристаллы, ионные кристаллы, металлические кристаллы и ван-дер-ваальсовы кристаллы. Последняя группа включает, в частности, молекулярные кристаллы. Это деление (как и деление хим. связи на типы) условно, однако типичные представители разных групп резко различаются по св-вам, напр. по энергии структуры (энергия, необходимая для разъединения твердого тела на отдельные атомы, ионы или молекулы, отнесенная к 1 молю кристаллич. в-ва).Так, для ковалентных кристаллов SiC энергия структуры 1180 кДж/моль, для ионных NaCl 752 кДж/моль, для металлич. Na 108 кДж/моль, для мол. кристаллов СН4 10 кДж/моль.
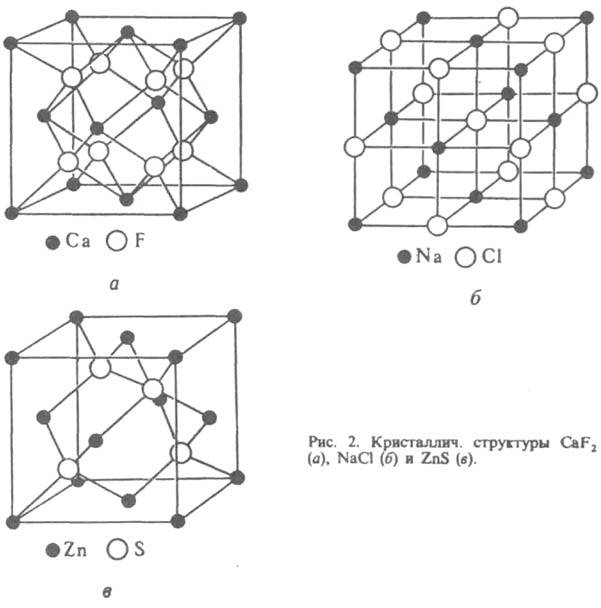
Важные характеристики К. с. - координац. числа К и координац. многогранники (полиэдры) атомов, из к-рых она состоит. Так, в структурах алмаза и сфалерита ZnS (рис. 2) для всех атомов К = 4 (координац. полиэдр - тетраэдр), в структуре NaCl К=6 (октаэдр), в структуре СаF2KCa=8 (куб), КF=4 (тетраэдр).
Зависимость свойств веществ от К. с. делает изучение К. с. важным в практич. отношении. Так, слоистые кристаллы графита, галогенидов Cd, MoS2 способны легко раскалываться по плоскостям, к-рые параллельны слоям; на этом св-ве основано использование этих в-в в качестве твердых смазок. Небольшое смещение атомов Ва и Ti из центров координац. полиэдров в кристаллах ВаТiO3 приводит к возникновению у этого в-ва сегнетоэлектрич. св-в.
Яркий пример зависимости св-в от строения дают цеолиты, К. с. к-рых содержат более или менее обширные полости с окнами, образованными в результате сцепления через общие вершины кремнекислородных и алюмокислородных тетраэдров SiO4 и АlО4. В результате кристаллы цеолитов избирательно поглощают более или менее крупные молекулы, их К. с. способна играть роль "мол. сита".
Так, шабазит Na[AlSi2O6].3H2O (в прир. минерале Na частично заменен на Са), в К. с. к-рого присутствуют окна из 6 и 8 сцепленных тетраэдров, поглощает молекулы н-октана, но не изооктана, что позволяет выделить из бензина изооктановую фракцию. Структура цеолитов во многом определяет также их каталитич. св-ва.
Лит. см. при статьях Кристаллохимия, Кристаллы. П. М. Зоркий.


