КОНДАКОВА РЕАКЦИЯ, присоединение галогенангидридов карбоновых к-т к олефинам и ацетиленам с образованием соотв. (b-галогенкетонов и b-галогенвинилкетонов:
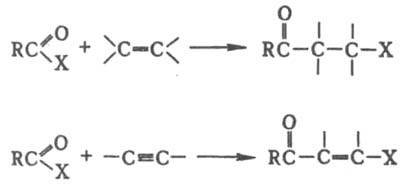
Катализаторами р-ции, как правило, служат к-ты Льюиса. Обычно для проведения К. р. готовят комплекс галогенан-гидрида с катализатором и затем вводят олефин или ацетилен. Средой служит избыток галогенангидрида или инертный р-ритель, напр. СН2Сl2, СНСl3, С2Н4Сl2, C6H5NO2. Применение алканов или CS2, в к-рых каталитич. комплекс не раств., дает худшие результаты. Т-ру р-ции варьируют от -10 до 20 °С, в отдетьных случаях реакц. смесь нагревают до 70-80 °С. В качестве ацилирующих агентов обычно применяют хлорангидриды, реже - бромангидриды (в последнем случае в качестве катализатора используют АlВr3). В К. р. вступают ациклич. и алициклич. олефины, терпеновые и сесквитерпеновые углеводороды, галогензамещенные этилены, а также ацетилен, фенилацетилен, моно- и диалкил-ацетилены. При наличии в молекуле b-галогенкетона атомов Н в a-положении к карбонильной группе может происходить отщепление галогеноводорода с образованием a,b-ненасыщенного кетона:
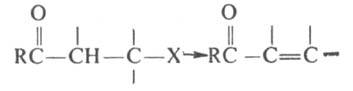
Иногда элиминирование галогеноводорода (гл. обр. для циклич. систем) приводит к b,g-ненасыщенным кетонам. В ряде случаев в зависимости от строения олефина и условий р-ции (напр., при нагр.) непредельные кетоны оказываются главными продуктами К. р. a-Галогенвинилкетоны в условиях К. р. галогеноводород не отщепляют.
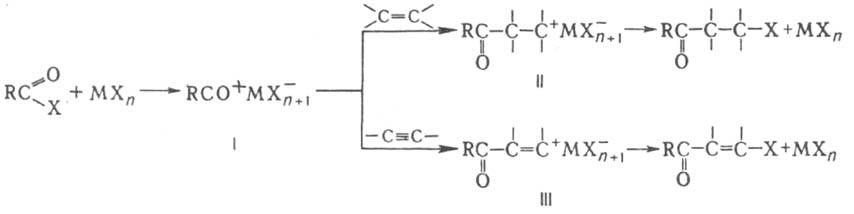
Механизм К. р. включает генерирование высокореакционноспособного ацилиевого комплекса I (МХn - к-та Льюиса), к-рый взаимод. с олефином с образованием карбкатионов II или III. В р-ции, подобной К. р., в качестве ацилирующего агента используют ангидрид уксусной к-ты; при этом образуются те же продукты р-ции, что и в случае ацетилхлорида. При использовании в качестве катализатора H2SO4 обычно образуются непредельные кетоны. Р-ция открыта И. Л. Кондаковым в 1893 и позднее изучалась С. Г. Крапивиным, А. Н. Несмеяновым и Н. К. Кочетковым; с ацетиленовыми углеводородами ее впервые провели в 1934 А. Корнилло и Р. Алкейр. Лит.. Кочетков Н. К., "Успехи химии". 1955, т. 24, в. 1, с. 32-51; Белов В. Н., Рудольфи Т. А., в кн.: Реакции и методы исследования органических соединений, кн. 7, М., 1958, с. 255-76. Н.Э. Нифантьев.

Катализаторами р-ции, как правило, служат к-ты Льюиса. Обычно для проведения К. р. готовят комплекс галогенан-гидрида с катализатором и затем вводят олефин или ацетилен. Средой служит избыток галогенангидрида или инертный р-ритель, напр. СН2Сl2, СНСl3, С2Н4Сl2, C6H5NO2. Применение алканов или CS2, в к-рых каталитич. комплекс не раств., дает худшие результаты. Т-ру р-ции варьируют от -10 до 20 °С, в отдетьных случаях реакц. смесь нагревают до 70-80 °С. В качестве ацилирующих агентов обычно применяют хлорангидриды, реже - бромангидриды (в последнем случае в качестве катализатора используют АlВr3). В К. р. вступают ациклич. и алициклич. олефины, терпеновые и сесквитерпеновые углеводороды, галогензамещенные этилены, а также ацетилен, фенилацетилен, моно- и диалкил-ацетилены. При наличии в молекуле b-галогенкетона атомов Н в a-положении к карбонильной группе может происходить отщепление галогеноводорода с образованием a,b-ненасыщенного кетона:
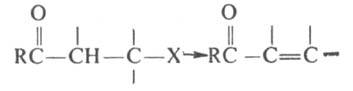
Иногда элиминирование галогеноводорода (гл. обр. для циклич. систем) приводит к b,g-ненасыщенным кетонам. В ряде случаев в зависимости от строения олефина и условий р-ции (напр., при нагр.) непредельные кетоны оказываются главными продуктами К. р. a-Галогенвинилкетоны в условиях К. р. галогеноводород не отщепляют.

Механизм К. р. включает генерирование высокореакционноспособного ацилиевого комплекса I (МХn - к-та Льюиса), к-рый взаимод. с олефином с образованием карбкатионов II или III. В р-ции, подобной К. р., в качестве ацилирующего агента используют ангидрид уксусной к-ты; при этом образуются те же продукты р-ции, что и в случае ацетилхлорида. При использовании в качестве катализатора H2SO4 обычно образуются непредельные кетоны. Р-ция открыта И. Л. Кондаковым в 1893 и позднее изучалась С. Г. Крапивиным, А. Н. Несмеяновым и Н. К. Кочетковым; с ацетиленовыми углеводородами ее впервые провели в 1934 А. Корнилло и Р. Алкейр. Лит.. Кочетков Н. К., "Успехи химии". 1955, т. 24, в. 1, с. 32-51; Белов В. Н., Рудольфи Т. А., в кн.: Реакции и методы исследования органических соединений, кн. 7, М., 1958, с. 255-76. Н.Э. Нифантьев.


