КОМПЛЕМЕНТ (система комплемента) (от лат. complementum - дополнение), группа глобулярных белков сыворотки крови животных и человека, представляющих собой часть иммунной системы организма. При попадании в организм инфицирующих его бактерий или вирусов, нек-рых токсинов или возникновении собственных трансформированных клеток происходит активация К., в результате чего клетки-мишени лизируются (разрушаются), а токсины и вирусы нейтрализуются. Поэтому систему К. рассматривают наряду с макрофагами как передовой рубеж иммунной защиты организма.
В ходе активации К. происходит каскад последоват. р-ций специфич. ограниченного ферментативного протеолиза, при к-рых неактивные компоненты К. переходят в активное
состояние в результате отщепления пептидных фрагментов. Последние обладают разл. физиол. активностью и м.б. анафилатоксинами (вызывают сокращения гладкой мускулатуры, увеличивают проницаемость сосудов и др.), факторами хемотаксиса (обеспечивают направленное перемещение клеток) и лейкоцитоза, медиаторами р-ций иммунного ответа, участвовать в активации макрофагов и лимфоцитов, в регуляции продуцирования антител, а также выполнять нек-рые др. ф-ции. Фрагменты активир. компонентов К. (продукты их ферментативного расщепления) управляют также биосинтезом и освобождением интерлейкинов, простагландинов и лейкотриенов. К. обусловливает нарушения иммунных р-ций (полиморфизм отдельных компонентов и факторов К. связан с предрасположенностью организма к аутоиммунным заболеваниям) и освобождение гистамина при аллергич. р-циях немедленного типа.
Активация К. включает этапы инициации (узнавания), амплификации (усиления ответа) и мембранной атаки. В активации К. по т. наз. классич. пути (см. рис.) участвуют 9
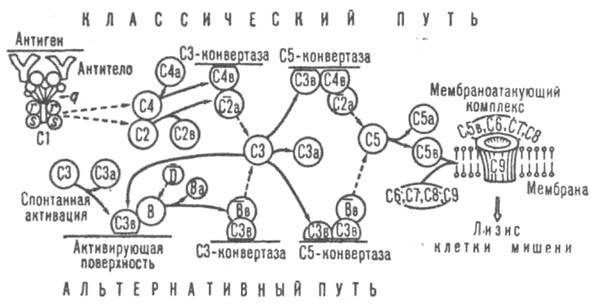
Схема активации комплемента. Сплошные стрелки показывают пути превращений компонентов комплемента, пунктирные стрелки проведены от фермента к его субстрату. компонентов (С1-С9). Она происходит на комплексах антиген-антитело, образованных иммуноглобулинами (Ig) классов G и М и содержащих в случае IgG по крайней мере две близко расположенные молекулы иммуноглобулина, с к-рыми связывается субкомпонент Clq (мол. м. 459,3 тыс.), состоящий из 6 субъединиц, каждая из к-рых содержит глобулярную часть (она связывается с СH2 - дoменом IgG) и коллагеноподобную структуру. С этого начинается стадия узнавания. Шесть трехцепочечных колла-геновых фибрилл объединены в центр, домене Clq в общий жгут. С фибриллами при участии ионов Са2+ связаны др. субкомпоненты Сl-Сlr и Cls (на рис. обозначены r и s) в виде тетрамера (Clr)2(Cls)2. Эти субкомпоненты представляют собой проферменты протеиназ серинового типа, активирующиеся в результате расщепления пептидной связи и имеющие мол. м. ок. 83 тыс. Далее происходит активация Сlr, по-видимому, в результате конформац. изменений Clq при сорбции его на комплексе антиген - антитело. Активированный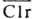 (черточкой сверху обозначены формы, обладающие ферментативной активностью) в свою очередь активирует Cls. Последний инициирует разветвленный каскад р-ций. Процесс контролируется ингибитором ClInh, действующим на протеиназы
(черточкой сверху обозначены формы, обладающие ферментативной активностью) в свою очередь активирует Cls. Последний инициирует разветвленный каскад р-ций. Процесс контролируется ингибитором ClInh, действующим на протеиназы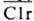 и
и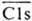 ; белковые ингибиторы протеиназ трипсина и химотрипсина, содержащиеся в крови, не действуют на эти и др. протеиназы К.
Компоненты С4 и
; белковые ингибиторы протеиназ трипсина и химотрипсина, содержащиеся в крови, не действуют на эти и др. протеиназы К.
Компоненты С4 и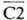 (мол. м. соотв. 201 тыс. и 108 тыс.) под действием Cls отщепляют анафилатоксины С4а и С2b (мол. м. соотв. 8 тыс. и 34 тыс.) с образованием активир. компонентов С4b и
(мол. м. соотв. 201 тыс. и 108 тыс.) под действием Cls отщепляют анафилатоксины С4а и С2b (мол. м. соотв. 8 тыс. и 34 тыс.) с образованием активир. компонентов С4b и 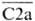 (мол. м. соотв. 193 тыс. и 74 тыс.).
Компоненты С4b и
(мол. м. соотв. 193 тыс. и 74 тыс.).
Компоненты С4b и 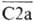 образуют комплекс
образуют комплекс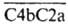 (т. наз. СЗ-конвертаза), в к-ром С2а содержит активный центр, а С4b связывается с мембраной клетки-мишени путем взаимод. b-карбоксильной группы аспарагиновой к-ты (до этого связанной с SH-группой остатка цистеина) с
гидроксильной группой соед., образующих клеточную пов-сть. Такая мембраносвязанная СЗ-конвертаза активирует СЗ (мол. м. 186 тыс.) с образованием анафилатоксина СЗа (мол. м. 9 тыс.) и активир. молекулы СЗb (мол. м. 177 тыс.), связывающейся ковалентно с клеточной мембраной по тому же механизму, что и С4b. Тиолсложноэфирная связь в этих молекулах конкурентно гидролизуется водой, поэтому активир. молекулы в р-ре существуют столь непродолжит. время, что активность сохраняют лишь молекулы, связавшиеся с мембраной клетки, с к-рой связана СЗ-конвертаза.
Связывание СЗb приводит к образованию С5-конвертазы -
(т. наз. СЗ-конвертаза), в к-ром С2а содержит активный центр, а С4b связывается с мембраной клетки-мишени путем взаимод. b-карбоксильной группы аспарагиновой к-ты (до этого связанной с SH-группой остатка цистеина) с
гидроксильной группой соед., образующих клеточную пов-сть. Такая мембраносвязанная СЗ-конвертаза активирует СЗ (мол. м. 186 тыс.) с образованием анафилатоксина СЗа (мол. м. 9 тыс.) и активир. молекулы СЗb (мол. м. 177 тыс.), связывающейся ковалентно с клеточной мембраной по тому же механизму, что и С4b. Тиолсложноэфирная связь в этих молекулах конкурентно гидролизуется водой, поэтому активир. молекулы в р-ре существуют столь непродолжит. время, что активность сохраняют лишь молекулы, связавшиеся с мембраной клетки, с к-рой связана СЗ-конвертаза.
Связывание СЗb приводит к образованию С5-конвертазы - 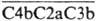 , в к-рой СЗb служит для сорбции субстрата С5 (мол. м. 180 тыс.) и его конформац. перестройки, делающей молекулы С5 доступными для гидролиза, в результате к-рого образуются два фрагмента - анафилатоксин С5а (мол. м. 11 тыс.), обладающей хемотаксич. активностью для гранулоцитов (вид лейкоцитов), и С5b (мол. м. 170 тыс.). Последний способен образовывать комплекс с С6, а затем с С7 и С8. Образующийся комплекс присоединяет неск. молекул С9 и формирует трансмембранный канал в клетке (диаметр ок. 10 нм), через к-рый свободно проходят ионы и низкомол. в-ва. В результате этого внутри клетки растет осмотич. давление, к-рос и приводит к разрыву клеточной оболочки и лизису. Один из регуляторных факторов этого процесса - белок S, связывающийся с комплексом С5bС6С7С8С9, что мешает фиксированию его на мембране и формированию мембраноатакующего комплекса.
В регуляции активации К. по классич. пути участвует также С4-связывающий белок (мол. м. 600 тыс.), к-рый способствует ферментативному разрушению С4b под действием фактора I (мол. м. 88 тыс.). Дальнейшие превращ. С4b и СЗb приводят к ряду функционально активных пептидов. Одни из них связываются со специфич. рецепторами на клетках иммунной системы, другие проявляют иные физиол. св-ва (напр., СЗе стимулирует лейкоцитоз).
Активация К. по альтернативному пути инициируется пов-стью клетки с регулярной (напр., полисахаридной) структурой. Такая пов-сть способна акцептировать образующийся активир. фрагмент СЗb. На мембраносвязанном СЗb сорбируется (в присут. ионов Mg2+ ) фактор В (мол. м. 92 тыс.), активирующийся ферментом - фактором
, в к-рой СЗb служит для сорбции субстрата С5 (мол. м. 180 тыс.) и его конформац. перестройки, делающей молекулы С5 доступными для гидролиза, в результате к-рого образуются два фрагмента - анафилатоксин С5а (мол. м. 11 тыс.), обладающей хемотаксич. активностью для гранулоцитов (вид лейкоцитов), и С5b (мол. м. 170 тыс.). Последний способен образовывать комплекс с С6, а затем с С7 и С8. Образующийся комплекс присоединяет неск. молекул С9 и формирует трансмембранный канал в клетке (диаметр ок. 10 нм), через к-рый свободно проходят ионы и низкомол. в-ва. В результате этого внутри клетки растет осмотич. давление, к-рос и приводит к разрыву клеточной оболочки и лизису. Один из регуляторных факторов этого процесса - белок S, связывающийся с комплексом С5bС6С7С8С9, что мешает фиксированию его на мембране и формированию мембраноатакующего комплекса.
В регуляции активации К. по классич. пути участвует также С4-связывающий белок (мол. м. 600 тыс.), к-рый способствует ферментативному разрушению С4b под действием фактора I (мол. м. 88 тыс.). Дальнейшие превращ. С4b и СЗb приводят к ряду функционально активных пептидов. Одни из них связываются со специфич. рецепторами на клетках иммунной системы, другие проявляют иные физиол. св-ва (напр., СЗе стимулирует лейкоцитоз).
Активация К. по альтернативному пути инициируется пов-стью клетки с регулярной (напр., полисахаридной) структурой. Такая пов-сть способна акцептировать образующийся активир. фрагмент СЗb. На мембраносвязанном СЗb сорбируется (в присут. ионов Mg2+ ) фактор В (мол. м. 92 тыс.), активирующийся ферментом - фактором 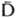 (мол. м. 25 тыс.). После отщепления от фактора В фрагмента Ва (мол. м. 32 тыс.) образуется фермент
(мол. м. 25 тыс.). После отщепления от фактора В фрагмента Ва (мол. м. 32 тыс.) образуется фермент 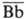 (мол. м. 60 тыс.), к-рый с СЗb образует комплекс
(мол. м. 60 тыс.), к-рый с СЗb образует комплекс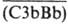 - СЗ-конвертазу альтернативного пути. СЗ-конвертаза аналогично классич. пути активации превращ. в комплекс (СЗbВbСЗb) - С5-конвертазу альтернативного пути. В дальнейшем активация осуществляется так же, как в классич. схеме.
Регуляция активации К. по альтернативному пути осуществляется следующим образом. Образованию СЗbВb препятствует фактор Н (мол. м. 150 тыс.), к-рый совместно с фактором I способствует ферментативному расщеплению СЗb. В то же время
- СЗ-конвертазу альтернативного пути. СЗ-конвертаза аналогично классич. пути активации превращ. в комплекс (СЗbВbСЗb) - С5-конвертазу альтернативного пути. В дальнейшем активация осуществляется так же, как в классич. схеме.
Регуляция активации К. по альтернативному пути осуществляется следующим образом. Образованию СЗbВb препятствует фактор Н (мол. м. 150 тыс.), к-рый совместно с фактором I способствует ферментативному расщеплению СЗb. В то же время 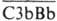 стабилизирует связывающийся с СЗb белок пропердин (мол. м. 150 тыс.).
Обнаружено также, что
стабилизирует связывающийся с СЗb белок пропердин (мол. м. 150 тыс.).
Обнаружено также, что 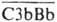 способен активировать компоненты С4 и С2 (с образованием классич. СЗ-конвертазы) и проферментную форму фактора D.
Увеличение или уменьшение содержания К. в организме наблюдается при мн. заболеваниях, напр. при воспалит. процессах, аутоиммунных и онкологич. заболеваниях. Препараты К. (сыворотка крови морской свинки) используют в диагностике при проведении р-ции связывания К. - определении кол-ва антител в крови (напр., в р-ции Вассермана).
Лит.: Кульберг А. Я., Молекулярная иммунология, М., 1985, с. 166 90: Козлов Л. В. [и др.], "Биоорганическая химия", 1982, т. 8. № 5, с. 652 59; там же, 1983. т. 9, № 8, с. 1047-55; Reid К. В. М., "Biochem. Soc. Trans.". 1983. v. 11, pt 1, p. 1-12; Muller-Eberhard H.J., Schreiber R. D., "Adv. Immunol.". 1980, v. 29, p. 1-53. Л. В. Козлов.
способен активировать компоненты С4 и С2 (с образованием классич. СЗ-конвертазы) и проферментную форму фактора D.
Увеличение или уменьшение содержания К. в организме наблюдается при мн. заболеваниях, напр. при воспалит. процессах, аутоиммунных и онкологич. заболеваниях. Препараты К. (сыворотка крови морской свинки) используют в диагностике при проведении р-ции связывания К. - определении кол-ва антител в крови (напр., в р-ции Вассермана).
Лит.: Кульберг А. Я., Молекулярная иммунология, М., 1985, с. 166 90: Козлов Л. В. [и др.], "Биоорганическая химия", 1982, т. 8. № 5, с. 652 59; там же, 1983. т. 9, № 8, с. 1047-55; Reid К. В. М., "Biochem. Soc. Trans.". 1983. v. 11, pt 1, p. 1-12; Muller-Eberhard H.J., Schreiber R. D., "Adv. Immunol.". 1980, v. 29, p. 1-53. Л. В. Козлов.

Схема активации комплемента. Сплошные стрелки показывают пути превращений компонентов комплемента, пунктирные стрелки проведены от фермента к его субстрату. компонентов (С1-С9). Она происходит на комплексах антиген-антитело, образованных иммуноглобулинами (Ig) классов G и М и содержащих в случае IgG по крайней мере две близко расположенные молекулы иммуноглобулина, с к-рыми связывается субкомпонент Clq (мол. м. 459,3 тыс.), состоящий из 6 субъединиц, каждая из к-рых содержит глобулярную часть (она связывается с СH2 - дoменом IgG) и коллагеноподобную структуру. С этого начинается стадия узнавания. Шесть трехцепочечных колла-геновых фибрилл объединены в центр, домене Clq в общий жгут. С фибриллами при участии ионов Са2+ связаны др. субкомпоненты Сl-Сlr и Cls (на рис. обозначены r и s) в виде тетрамера (Clr)2(Cls)2. Эти субкомпоненты представляют собой проферменты протеиназ серинового типа, активирующиеся в результате расщепления пептидной связи и имеющие мол. м. ок. 83 тыс. Далее происходит активация Сlr, по-видимому, в результате конформац. изменений Clq при сорбции его на комплексе антиген - антитело. Активированный
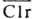 (черточкой сверху обозначены формы, обладающие ферментативной активностью) в свою очередь активирует Cls. Последний инициирует разветвленный каскад р-ций. Процесс контролируется ингибитором ClInh, действующим на протеиназы
(черточкой сверху обозначены формы, обладающие ферментативной активностью) в свою очередь активирует Cls. Последний инициирует разветвленный каскад р-ций. Процесс контролируется ингибитором ClInh, действующим на протеиназы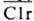 и
и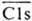 ; белковые ингибиторы протеиназ трипсина и химотрипсина, содержащиеся в крови, не действуют на эти и др. протеиназы К.
Компоненты С4 и
; белковые ингибиторы протеиназ трипсина и химотрипсина, содержащиеся в крови, не действуют на эти и др. протеиназы К.
Компоненты С4 и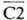 (мол. м. соотв. 201 тыс. и 108 тыс.) под действием Cls отщепляют анафилатоксины С4а и С2b (мол. м. соотв. 8 тыс. и 34 тыс.) с образованием активир. компонентов С4b и
(мол. м. соотв. 201 тыс. и 108 тыс.) под действием Cls отщепляют анафилатоксины С4а и С2b (мол. м. соотв. 8 тыс. и 34 тыс.) с образованием активир. компонентов С4b и 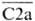 (мол. м. соотв. 193 тыс. и 74 тыс.).
Компоненты С4b и
(мол. м. соотв. 193 тыс. и 74 тыс.).
Компоненты С4b и 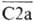 образуют комплекс
образуют комплекс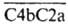 (т. наз. СЗ-конвертаза), в к-ром С2а содержит активный центр, а С4b связывается с мембраной клетки-мишени путем взаимод. b-карбоксильной группы аспарагиновой к-ты (до этого связанной с SH-группой остатка цистеина) с
гидроксильной группой соед., образующих клеточную пов-сть. Такая мембраносвязанная СЗ-конвертаза активирует СЗ (мол. м. 186 тыс.) с образованием анафилатоксина СЗа (мол. м. 9 тыс.) и активир. молекулы СЗb (мол. м. 177 тыс.), связывающейся ковалентно с клеточной мембраной по тому же механизму, что и С4b. Тиолсложноэфирная связь в этих молекулах конкурентно гидролизуется водой, поэтому активир. молекулы в р-ре существуют столь непродолжит. время, что активность сохраняют лишь молекулы, связавшиеся с мембраной клетки, с к-рой связана СЗ-конвертаза.
Связывание СЗb приводит к образованию С5-конвертазы -
(т. наз. СЗ-конвертаза), в к-ром С2а содержит активный центр, а С4b связывается с мембраной клетки-мишени путем взаимод. b-карбоксильной группы аспарагиновой к-ты (до этого связанной с SH-группой остатка цистеина) с
гидроксильной группой соед., образующих клеточную пов-сть. Такая мембраносвязанная СЗ-конвертаза активирует СЗ (мол. м. 186 тыс.) с образованием анафилатоксина СЗа (мол. м. 9 тыс.) и активир. молекулы СЗb (мол. м. 177 тыс.), связывающейся ковалентно с клеточной мембраной по тому же механизму, что и С4b. Тиолсложноэфирная связь в этих молекулах конкурентно гидролизуется водой, поэтому активир. молекулы в р-ре существуют столь непродолжит. время, что активность сохраняют лишь молекулы, связавшиеся с мембраной клетки, с к-рой связана СЗ-конвертаза.
Связывание СЗb приводит к образованию С5-конвертазы - 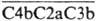 , в к-рой СЗb служит для сорбции субстрата С5 (мол. м. 180 тыс.) и его конформац. перестройки, делающей молекулы С5 доступными для гидролиза, в результате к-рого образуются два фрагмента - анафилатоксин С5а (мол. м. 11 тыс.), обладающей хемотаксич. активностью для гранулоцитов (вид лейкоцитов), и С5b (мол. м. 170 тыс.). Последний способен образовывать комплекс с С6, а затем с С7 и С8. Образующийся комплекс присоединяет неск. молекул С9 и формирует трансмембранный канал в клетке (диаметр ок. 10 нм), через к-рый свободно проходят ионы и низкомол. в-ва. В результате этого внутри клетки растет осмотич. давление, к-рос и приводит к разрыву клеточной оболочки и лизису. Один из регуляторных факторов этого процесса - белок S, связывающийся с комплексом С5bС6С7С8С9, что мешает фиксированию его на мембране и формированию мембраноатакующего комплекса.
В регуляции активации К. по классич. пути участвует также С4-связывающий белок (мол. м. 600 тыс.), к-рый способствует ферментативному разрушению С4b под действием фактора I (мол. м. 88 тыс.). Дальнейшие превращ. С4b и СЗb приводят к ряду функционально активных пептидов. Одни из них связываются со специфич. рецепторами на клетках иммунной системы, другие проявляют иные физиол. св-ва (напр., СЗе стимулирует лейкоцитоз).
Активация К. по альтернативному пути инициируется пов-стью клетки с регулярной (напр., полисахаридной) структурой. Такая пов-сть способна акцептировать образующийся активир. фрагмент СЗb. На мембраносвязанном СЗb сорбируется (в присут. ионов Mg2+ ) фактор В (мол. м. 92 тыс.), активирующийся ферментом - фактором
, в к-рой СЗb служит для сорбции субстрата С5 (мол. м. 180 тыс.) и его конформац. перестройки, делающей молекулы С5 доступными для гидролиза, в результате к-рого образуются два фрагмента - анафилатоксин С5а (мол. м. 11 тыс.), обладающей хемотаксич. активностью для гранулоцитов (вид лейкоцитов), и С5b (мол. м. 170 тыс.). Последний способен образовывать комплекс с С6, а затем с С7 и С8. Образующийся комплекс присоединяет неск. молекул С9 и формирует трансмембранный канал в клетке (диаметр ок. 10 нм), через к-рый свободно проходят ионы и низкомол. в-ва. В результате этого внутри клетки растет осмотич. давление, к-рос и приводит к разрыву клеточной оболочки и лизису. Один из регуляторных факторов этого процесса - белок S, связывающийся с комплексом С5bС6С7С8С9, что мешает фиксированию его на мембране и формированию мембраноатакующего комплекса.
В регуляции активации К. по классич. пути участвует также С4-связывающий белок (мол. м. 600 тыс.), к-рый способствует ферментативному разрушению С4b под действием фактора I (мол. м. 88 тыс.). Дальнейшие превращ. С4b и СЗb приводят к ряду функционально активных пептидов. Одни из них связываются со специфич. рецепторами на клетках иммунной системы, другие проявляют иные физиол. св-ва (напр., СЗе стимулирует лейкоцитоз).
Активация К. по альтернативному пути инициируется пов-стью клетки с регулярной (напр., полисахаридной) структурой. Такая пов-сть способна акцептировать образующийся активир. фрагмент СЗb. На мембраносвязанном СЗb сорбируется (в присут. ионов Mg2+ ) фактор В (мол. м. 92 тыс.), активирующийся ферментом - фактором 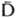 (мол. м. 25 тыс.). После отщепления от фактора В фрагмента Ва (мол. м. 32 тыс.) образуется фермент
(мол. м. 25 тыс.). После отщепления от фактора В фрагмента Ва (мол. м. 32 тыс.) образуется фермент 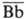 (мол. м. 60 тыс.), к-рый с СЗb образует комплекс
(мол. м. 60 тыс.), к-рый с СЗb образует комплекс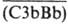 - СЗ-конвертазу альтернативного пути. СЗ-конвертаза аналогично классич. пути активации превращ. в комплекс (СЗbВbСЗb) - С5-конвертазу альтернативного пути. В дальнейшем активация осуществляется так же, как в классич. схеме.
Регуляция активации К. по альтернативному пути осуществляется следующим образом. Образованию СЗbВb препятствует фактор Н (мол. м. 150 тыс.), к-рый совместно с фактором I способствует ферментативному расщеплению СЗb. В то же время
- СЗ-конвертазу альтернативного пути. СЗ-конвертаза аналогично классич. пути активации превращ. в комплекс (СЗbВbСЗb) - С5-конвертазу альтернативного пути. В дальнейшем активация осуществляется так же, как в классич. схеме.
Регуляция активации К. по альтернативному пути осуществляется следующим образом. Образованию СЗbВb препятствует фактор Н (мол. м. 150 тыс.), к-рый совместно с фактором I способствует ферментативному расщеплению СЗb. В то же время 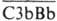 стабилизирует связывающийся с СЗb белок пропердин (мол. м. 150 тыс.).
Обнаружено также, что
стабилизирует связывающийся с СЗb белок пропердин (мол. м. 150 тыс.).
Обнаружено также, что 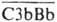 способен активировать компоненты С4 и С2 (с образованием классич. СЗ-конвертазы) и проферментную форму фактора D.
Увеличение или уменьшение содержания К. в организме наблюдается при мн. заболеваниях, напр. при воспалит. процессах, аутоиммунных и онкологич. заболеваниях. Препараты К. (сыворотка крови морской свинки) используют в диагностике при проведении р-ции связывания К. - определении кол-ва антител в крови (напр., в р-ции Вассермана).
Лит.: Кульберг А. Я., Молекулярная иммунология, М., 1985, с. 166 90: Козлов Л. В. [и др.], "Биоорганическая химия", 1982, т. 8. № 5, с. 652 59; там же, 1983. т. 9, № 8, с. 1047-55; Reid К. В. М., "Biochem. Soc. Trans.". 1983. v. 11, pt 1, p. 1-12; Muller-Eberhard H.J., Schreiber R. D., "Adv. Immunol.". 1980, v. 29, p. 1-53. Л. В. Козлов.
способен активировать компоненты С4 и С2 (с образованием классич. СЗ-конвертазы) и проферментную форму фактора D.
Увеличение или уменьшение содержания К. в организме наблюдается при мн. заболеваниях, напр. при воспалит. процессах, аутоиммунных и онкологич. заболеваниях. Препараты К. (сыворотка крови морской свинки) используют в диагностике при проведении р-ции связывания К. - определении кол-ва антител в крови (напр., в р-ции Вассермана).
Лит.: Кульберг А. Я., Молекулярная иммунология, М., 1985, с. 166 90: Козлов Л. В. [и др.], "Биоорганическая химия", 1982, т. 8. № 5, с. 652 59; там же, 1983. т. 9, № 8, с. 1047-55; Reid К. В. М., "Biochem. Soc. Trans.". 1983. v. 11, pt 1, p. 1-12; Muller-Eberhard H.J., Schreiber R. D., "Adv. Immunol.". 1980, v. 29, p. 1-53. Л. В. Козлов.


