КОЛХИЦИНОВЫЕ АЛКАЛОИДЫ (трополоновые алкалоиды), соединения обшей ф-лы I, выделенные из растений семейства лилейных (Liliaceae). наиб. богаты ими растения родов безвременник (Colchicum L.), мерендера (Merendera Ramond) и глориоза (Gloriosa L.).
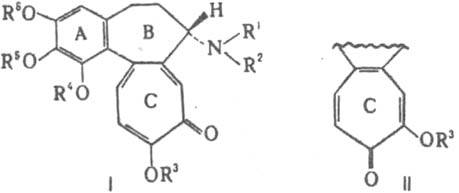
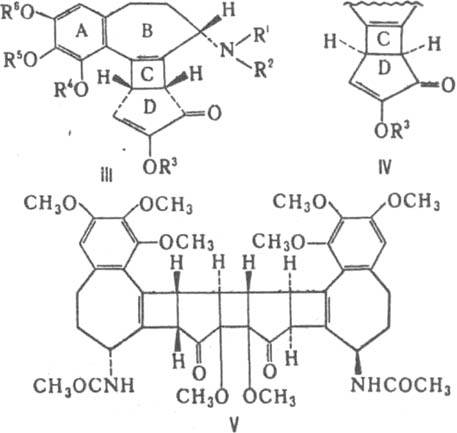
К. а. включают ок. 30 соед., различающихся в осн. содержанием гидрокси-, метокси-, метилендиоксигрупп в кольце А, гидрокси- и метоксигрупп в кольце С. Аминогруппа кольца В первичная или содержит заместители - метильную, ацетильную, формильную или др. группы. Осн. представители К. а.-колхицин (ф-ла I, R1=Н, R2=СОСН3, R3=R4=R5=R6=СН3) и колхамин (I, R1=Н, R2=R3=R4=R5=R6=СН3). Колхицин - бесцв. кристаллы с т.пл. 155-157°С, [а]D16 -121° (хлороформ). Ряд специфич. св-в к. а. обусловлен гл. обр. присутствием трополонового кольца С. Метоксигруппа этого цикла легко гидролизуется в р-рах к-т и щелочей, замещается на амино-, тио- и др. группы. При гидролизе образуются соед. с R3=Н, существующие в двух таутомерных формах (I и II). При метилировании они дают смесь двух изомерных эфиров (I и II, R3=СН3). Под действием солнечного света и УФ излучения К. а. образуют a-, b- и g - люмиколхицины. Последние два имеют общее строение, различаясь сочленением колец С и D (соотв. III и IV). a-Люмиколхицин (V) представляет собой димер. Трополоновое кольцо легко трансформируется в ароматическое. Напр., при взаимод. колхицина с CH3ONa образуется колхициновая к-та (VI), с Н2О2-N-ацетилколхинол (VII), с KIO-N-ацетилиодколхинол (VIII), с KBrO-N-ацетилдибромколхинол (IX). При длит, нагревании колхицина в этиленгликоле выделены дезокси-N-ацетилколхинол (X), О-гидроксиэтил-N-ацетилколхинол (XI) и гидроксиэтиловый эфир соединения VI (XII).
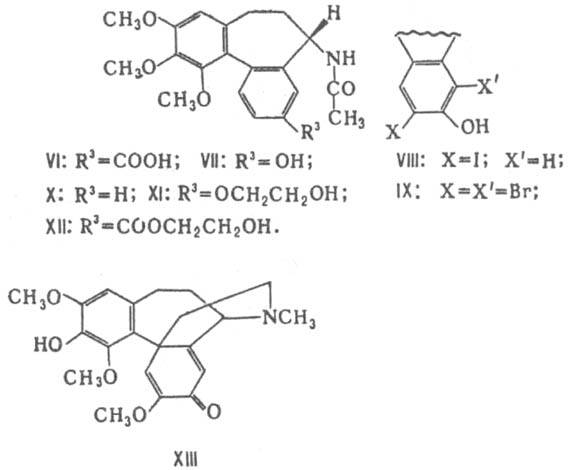
Соед. типа III, IV и VI выделены из растений. В природе К. а. образуются гл. обр. из фенилаланина и тирозина через гомоморфинандиеноновые основания, напр. андроцимбина (XIII) и его аналогов. Осуществлен хим. синтез колхицина и большого кол-ва его производных. Безвременники и др. растения, содержащие К. а., сильно ядовиты. Они относятся к древнейшим лек. растениям; препараты из них, а впоследствии колхицин и его салицилат применялись как болеутоляющие ср-ва при приступах подагры и суставном ревматизме. К.а. - сильные антимитотики. Колхицин используется в биологии как полиплоидизирующее в-во для получения новых сортов с.-х. культур (колхиплоидия), а колхамин-в медицине в качестве противоопухолевого ср-ва. Лит.. Киселев В. В., "Химия прир. соед.", 1977, № 1, с. 3-13; Юсупов М.К., Садыков А.С, там же, 1978, № 1, с. 3-26. М. К. Юсупов.


К. а. включают ок. 30 соед., различающихся в осн. содержанием гидрокси-, метокси-, метилендиоксигрупп в кольце А, гидрокси- и метоксигрупп в кольце С. Аминогруппа кольца В первичная или содержит заместители - метильную, ацетильную, формильную или др. группы. Осн. представители К. а.-колхицин (ф-ла I, R1=Н, R2=СОСН3, R3=R4=R5=R6=СН3) и колхамин (I, R1=Н, R2=R3=R4=R5=R6=СН3). Колхицин - бесцв. кристаллы с т.пл. 155-157°С, [а]D16 -121° (хлороформ). Ряд специфич. св-в к. а. обусловлен гл. обр. присутствием трополонового кольца С. Метоксигруппа этого цикла легко гидролизуется в р-рах к-т и щелочей, замещается на амино-, тио- и др. группы. При гидролизе образуются соед. с R3=Н, существующие в двух таутомерных формах (I и II). При метилировании они дают смесь двух изомерных эфиров (I и II, R3=СН3). Под действием солнечного света и УФ излучения К. а. образуют a-, b- и g - люмиколхицины. Последние два имеют общее строение, различаясь сочленением колец С и D (соотв. III и IV). a-Люмиколхицин (V) представляет собой димер. Трополоновое кольцо легко трансформируется в ароматическое. Напр., при взаимод. колхицина с CH3ONa образуется колхициновая к-та (VI), с Н2О2-N-ацетилколхинол (VII), с KIO-N-ацетилиодколхинол (VIII), с KBrO-N-ацетилдибромколхинол (IX). При длит, нагревании колхицина в этиленгликоле выделены дезокси-N-ацетилколхинол (X), О-гидроксиэтил-N-ацетилколхинол (XI) и гидроксиэтиловый эфир соединения VI (XII).

Соед. типа III, IV и VI выделены из растений. В природе К. а. образуются гл. обр. из фенилаланина и тирозина через гомоморфинандиеноновые основания, напр. андроцимбина (XIII) и его аналогов. Осуществлен хим. синтез колхицина и большого кол-ва его производных. Безвременники и др. растения, содержащие К. а., сильно ядовиты. Они относятся к древнейшим лек. растениям; препараты из них, а впоследствии колхицин и его салицилат применялись как болеутоляющие ср-ва при приступах подагры и суставном ревматизме. К.а. - сильные антимитотики. Колхицин используется в биологии как полиплоидизирующее в-во для получения новых сортов с.-х. культур (колхиплоидия), а колхамин-в медицине в качестве противоопухолевого ср-ва. Лит.. Киселев В. В., "Химия прир. соед.", 1977, № 1, с. 3-13; Юсупов М.К., Садыков А.С, там же, 1978, № 1, с. 3-26. М. К. Юсупов.


