КНOРРА РЕАКЦИЯ, синтез пирролов взаимодействием a-аминокетонов с карбонильными соед., содержащими активир. a-метиленовую группу:
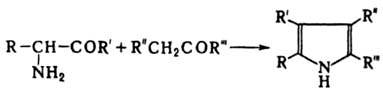
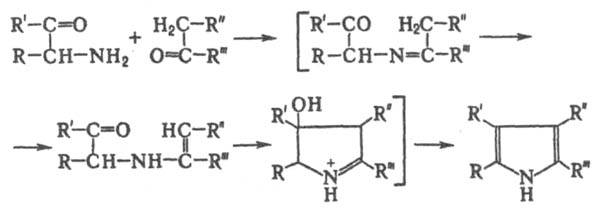
Проводят нагреванием смеси реагентов в уксусной к-те. Р-ция протекает с высоким выходом, если R' и R''' - алкил, арил, ацил, алкоксикарбонил, R и R'' - ацил, алкоксикарбонил; при R-H, алкил, арил и R'' - алкил выходы ниже. Предполагают, что на первой стадии р-ции СО - группа карбонильного компонента взаимод. с аминогруппой, на второй происходит замыкание цикла:
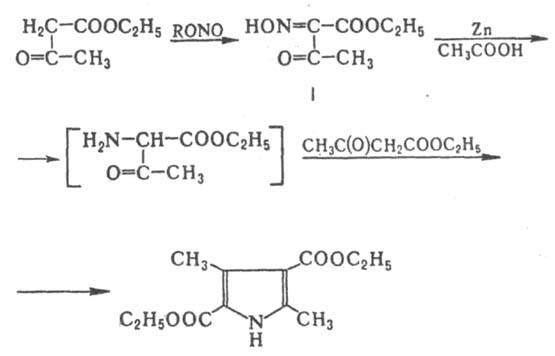
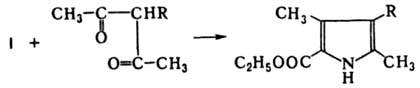
a-Аминокетоны склонны к самоконденсации с образованием производных пиразина, поэтому в К. р. их вводят в виде гидрохлоридов или используют в момент получения при восстановлении a-изонитрозокетонов. Пример такого проведения К. р.-синтез т. наз. пиррола Кнорра через a-гидроксиминоацетоуксусный эфир (ф-ла I):
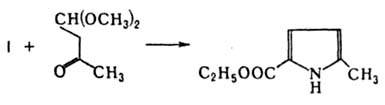
Известен ряд модификаций К. р., включающих стадию - отщепления ацильного фрагмента аминокетона; этими способами можно успешно получать не только ацил- и алкоксикарбонилпирролы, но и алкилпирролы. Так, при использовании в качестве карбонильного компонента производных b-кетоальдегидов образуются не пирролкарбальдегиды, а алкилзамещенные пирролы:
Подобным образом идет р-ция с a-алкил-b-дикетонами.
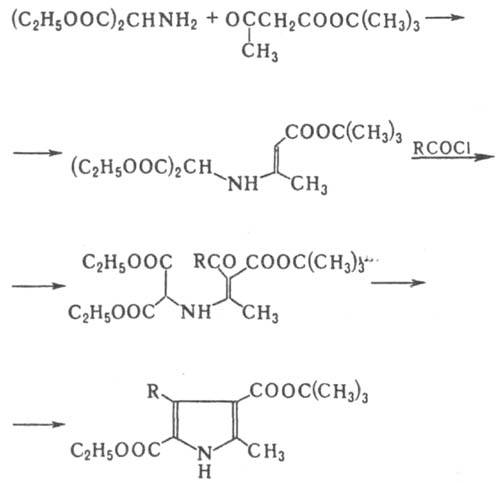
В случае р-ции аминомалонового эфира с b-кетоэфирами образуется енамин, ацилирование к-рого позволяет осуществить циклизацию, напр.:
Вместо а-аминокетонов или a-изонитрозокетонов в К. р. могут быть использованы монофенилгидразоны b-дикетонов, напр.:
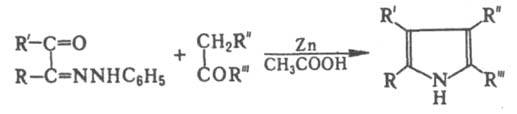
Р-ция открыта Л. Кнорром в 1884. К К. р. иногда относят также след, р-ции: 1. Синтез пирролов из 1,4-дикарбонильных соед. и NH3 или первичных аминов:
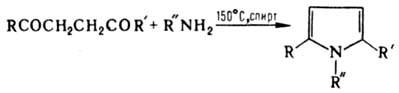
R и R' - алкил, ОН, NH2, NHR. Р-ция открыта в 1885 независимо Л. Кнорром и С. Паалем; иногда наз. р-цией Пааля-Кнорра. 2. Синтез 2-хинолонов из a-кетоэфиров и ариламинов:
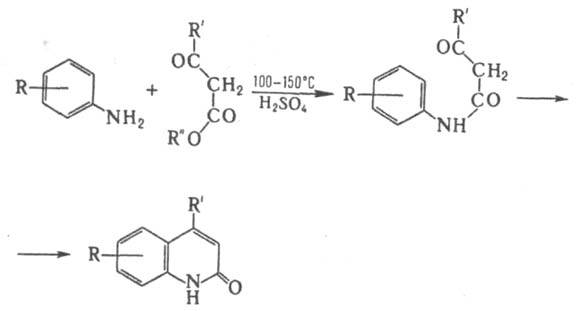
Р-ция открыта Л. Кнорром в 1886. 3. Синтез пиразолов из 1,3-дикарбонильных соед. и гидразинов:
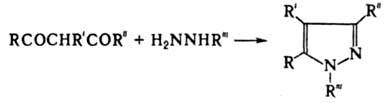
Р-ция открыта Л. Кнорром в 1883. Лит.: Гетероциклические соединения, под ред. Р. Эльдерфилда, пер. с англ., т. I, M., 1953, с. 222 24; Вацуро К. В., Мищенко Г.Л., Именные реакции в органической химии, М., 1976, с. 216-18; Общая органическая химия, пер. с англ., т. 8, М., 1985, с. 198, 204, 356 60. , Л. И. Беленький.
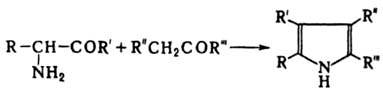
Проводят нагреванием смеси реагентов в уксусной к-те. Р-ция протекает с высоким выходом, если R' и R''' - алкил, арил, ацил, алкоксикарбонил, R и R'' - ацил, алкоксикарбонил; при R-H, алкил, арил и R'' - алкил выходы ниже. Предполагают, что на первой стадии р-ции СО - группа карбонильного компонента взаимод. с аминогруппой, на второй происходит замыкание цикла:

a-Аминокетоны склонны к самоконденсации с образованием производных пиразина, поэтому в К. р. их вводят в виде гидрохлоридов или используют в момент получения при восстановлении a-изонитрозокетонов. Пример такого проведения К. р.-синтез т. наз. пиррола Кнорра через a-гидроксиминоацетоуксусный эфир (ф-ла I):

Известен ряд модификаций К. р., включающих стадию - отщепления ацильного фрагмента аминокетона; этими способами можно успешно получать не только ацил- и алкоксикарбонилпирролы, но и алкилпирролы. Так, при использовании в качестве карбонильного компонента производных b-кетоальдегидов образуются не пирролкарбальдегиды, а алкилзамещенные пирролы:

Подобным образом идет р-ция с a-алкил-b-дикетонами.

В случае р-ции аминомалонового эфира с b-кетоэфирами образуется енамин, ацилирование к-рого позволяет осуществить циклизацию, напр.:

Вместо а-аминокетонов или a-изонитрозокетонов в К. р. могут быть использованы монофенилгидразоны b-дикетонов, напр.:
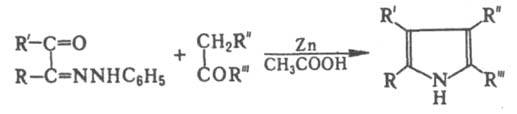
Р-ция открыта Л. Кнорром в 1884. К К. р. иногда относят также след, р-ции: 1. Синтез пирролов из 1,4-дикарбонильных соед. и NH3 или первичных аминов:
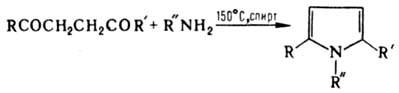
R и R' - алкил, ОН, NH2, NHR. Р-ция открыта в 1885 независимо Л. Кнорром и С. Паалем; иногда наз. р-цией Пааля-Кнорра. 2. Синтез 2-хинолонов из a-кетоэфиров и ариламинов:

Р-ция открыта Л. Кнорром в 1886. 3. Синтез пиразолов из 1,3-дикарбонильных соед. и гидразинов:
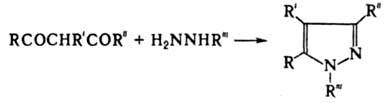
Р-ция открыта Л. Кнорром в 1883. Лит.: Гетероциклические соединения, под ред. Р. Эльдерфилда, пер. с англ., т. I, M., 1953, с. 222 24; Вацуро К. В., Мищенко Г.Л., Именные реакции в органической химии, М., 1976, с. 216-18; Общая органическая химия, пер. с англ., т. 8, М., 1985, с. 198, 204, 356 60. , Л. И. Беленький.


