КИЛИАНИ-ФИШЕРА РЕАКЦИЯ (циангидриновый синтез альдоз), удлинение углеродной цепи алъдоз на одно гидроксиметиленовое звено. Протекает через стадии превращения альдозы в циангидрины, гидролиза последних в альдоновые к-ты и восстановления их лактонов, напр.:
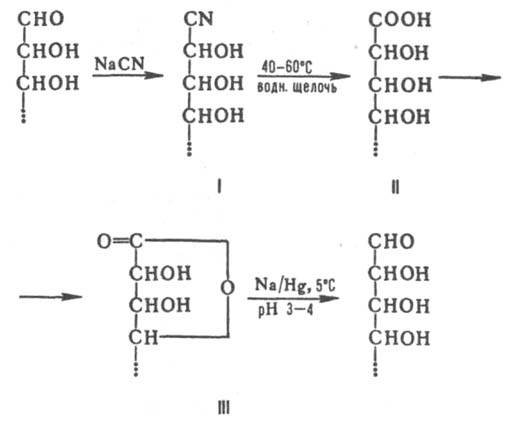
Присоединение группы CN приводит к смеси эпимерных циангидринов (ф-ла I), соотношение к-рых зависит от строения исходной альдозы и условий проведения р-ции, в частности рН среды и присутствия добавок солей. Циангидрины обычно получают взаимод. альдоз с водными р-рами NH4CN при рН 9,0-9,1 или по р-ции альдоз с водным р-ром NaCN на холоду в присут. СаС12, ВаС12, NH4Cl или без них. В первом случае наблюдается предпочтительное образование циангидринов с транс-расположением групп ОН при атомах С-2 и С-4. Циангидрины м. б. также получены взаимод. альдоз с р-рами HCN в абс. пиридине или ДМФА в присут. триэтиламина. Гидролиз циангидринов протекает в течение неск. часов при 50-80 °С в водных р-рах Na2CO3, Ba(OH)2 или Са(ОН)2. При послед. подкислении р-ром H2SO4 или обработке ка-тионитами получаются альдоновые к-ты (II), самопроизвольно превращающиеся в лактоны (III). Разделение образующихся эпимеров альдоновых к-т обычно проводят хроматографически, а также дробной кристаллизацией их солей, лактонов, амидов или фенилгидразидов. Превращ. лактонов в альдозы осуществляют действием амальгамы Na в водных р-рах в присут. катионита (рН 3,0-3,5, т-ра [5 °С); электролитич. восстановлением на ртутном катоде; каталитич. гидрогенолизом над РtO2; действием NaBH4 в водных р-рах (рН 3-4). К.-Ф. р. разработана на основе работ Г. Килиани, изучавшего присоединение HCN к альдозам и гидролиз циангидринов (1885-89), и Э. Фишера по восстановлению альдонолактонов с помощью амальгамы Na (1889-95). Лит.. Химия углеводов, М., 1967; Степаяеико Б. Н., Химия и биохимия углеводов. Моносахариды, М., 1977, с. 119; Webber J. М., в кн.. Advances in carbohydrate chemistry, v. 17, N.Y., 1962, p. 15 63. Н.Э. Нифантьев.

Присоединение группы CN приводит к смеси эпимерных циангидринов (ф-ла I), соотношение к-рых зависит от строения исходной альдозы и условий проведения р-ции, в частности рН среды и присутствия добавок солей. Циангидрины обычно получают взаимод. альдоз с водными р-рами NH4CN при рН 9,0-9,1 или по р-ции альдоз с водным р-ром NaCN на холоду в присут. СаС12, ВаС12, NH4Cl или без них. В первом случае наблюдается предпочтительное образование циангидринов с транс-расположением групп ОН при атомах С-2 и С-4. Циангидрины м. б. также получены взаимод. альдоз с р-рами HCN в абс. пиридине или ДМФА в присут. триэтиламина. Гидролиз циангидринов протекает в течение неск. часов при 50-80 °С в водных р-рах Na2CO3, Ba(OH)2 или Са(ОН)2. При послед. подкислении р-ром H2SO4 или обработке ка-тионитами получаются альдоновые к-ты (II), самопроизвольно превращающиеся в лактоны (III). Разделение образующихся эпимеров альдоновых к-т обычно проводят хроматографически, а также дробной кристаллизацией их солей, лактонов, амидов или фенилгидразидов. Превращ. лактонов в альдозы осуществляют действием амальгамы Na в водных р-рах в присут. катионита (рН 3,0-3,5, т-ра [5 °С); электролитич. восстановлением на ртутном катоде; каталитич. гидрогенолизом над РtO2; действием NaBH4 в водных р-рах (рН 3-4). К.-Ф. р. разработана на основе работ Г. Килиани, изучавшего присоединение HCN к альдозам и гидролиз циангидринов (1885-89), и Э. Фишера по восстановлению альдонолактонов с помощью амальгамы Na (1889-95). Лит.. Химия углеводов, М., 1967; Степаяеико Б. Н., Химия и биохимия углеводов. Моносахариды, М., 1977, с. 119; Webber J. М., в кн.. Advances in carbohydrate chemistry, v. 17, N.Y., 1962, p. 15 63. Н.Э. Нифантьев.


