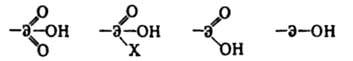
(в зависимости от валентности элемента Э=S, P, As, С; X=ОН, Н, R), природой элемента, числом атомов =О у атома Э, а также природой матрицы и сшивающего агента. По кислотности ионогенных групп К. с. подразделяют б. ч. на сильно-, средне- и слабокислотные (кислотность смолы определяют значением pКа). Смолы первого типа содержат группы SO3H(pKа 1-2), второго типа-Р(О)(Х)ОН, где X = Н, ОН, R, OR; R-opг. или любая др. группа [рКа ~ 3-4,5; для Р(О)(ОН)2 рКа2 ~ 8-10], смолы третьего типа-группы СООН, ArOH, ArSH, Аr(ОН)2, рКа 5-10. Существуют также бифункц. К. с., содержащие одновременно группы SO3H и СООН, SO3H и С6Н4ОН, СООН и С6Н4ОН. Обменная емкость для сильнокислотных К. с, в отличие от слабо- и среднекислотных не зависит От рН р-ра. По структуре м. б. микропористыми, или гелевыми, и макропористыми (см. Макропористые ионообменные смолы). Методы получения: 1) полимераналогичные превращ. сетчатых сополимеров (гл. обр. стирола с дивинил бензолом), напр, сульфирование, фосфорилирование гидроксилсодержащих сополимеров; 2) сополимеризация или сопо-ликонденсация соответствующих мономеров, напр. поликонденсация сулъфокислот с альдегидами, полимеризация фосфорсодержащих мономеров, производных акриловой к-ты с диенами. К. с.-твердые, нерастворимые, ограниченно набухающие продукты; достаточно устойчивы в р-рах к-т и щелочей, орг. р-рителях. Сильные окислители (Н2О2, К2Сr2О7, HNO3) разрушают К. с., отщепляя б. ч. ионогенные группы; фосфорсодержащие катиониты более устойчивы, чем сульфокислотные. Термостойкость смолы с группами Р(О)(ОН)2 составляет 150-175 °С, с группами SО3Н - до 120-150 °С, с группами СООН - 130-160 °С. К. с. поликонденсац. типа менее химически и термически стойки, чем смолы полимеризац. типа. Мех. прочность достаточно высока, особенно у гранулир. и макропористых смол. Избирательность сульфокислотных К. с. уменьшается в ряду ионов К+>Na>Li+ с увеличением размера гидратир. иона и возрастает в ряду металлов М1+<М2+<М3+. Для фосфорнокислотных и карбоксильных К. с. характерна высокая избирательность по отношению к поливалентным металлам, в т. ч. способным к комплексообразованию, и металлам, дающим оксидные катионы, напр. UO22+ , VO2+. Применяют К. с. при водоподготовке (также и в сочетании с анионообменными смолами), в гидрометаллургии для избирательного извлечения поливалентных металлов, для извлечения из р-ров неорг. и орг. в-в основного характера, для селективного выделения ценных, биологически активных в-в из биосырья, как кислотные кат. (напр., при этерификации к-т, гидролизе эфиров) и носители катализаторов, ферментов, комплексонов, для получения гетерог. мембран и др. См. также Иониты. Лит.: Самсонов Г. В., Тростянская Е. Б., Елькин Г. Э., Ионный обмен. Л., 1969; Энциклопедия полимеров, т. 1, М., 1972, с. 992-1000; Ионообменные материалы. Каталог. НПО Биохимреактив, М., 1978; Иониты. Каталог, НИИТЭХИМ, Черкассы, 1980; Гребенюк В. Д., Мазо А. А., Обессоливапие воды ионитами, М., 1980. А. Б. Пашков.


