КАРБОЛИНЫ (пиридо[b]индолы), мол. м. 168,2. В зависимости от положения атома азота в пиридиновом кольце различают четыре изомера - a (ф-ла I, т. пл. 218°С, пикрата 260-264°С), b (т.пл. 198,5°С), пикрата 260 °С), g (т.пл. 250°С), d (т.пл. 214 215°С). Хорошо раств. в метаноле, этаноле, ацетоне, этилацетате, умеренно - в эфире, бензоле, воде.
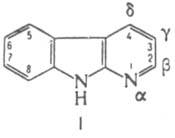
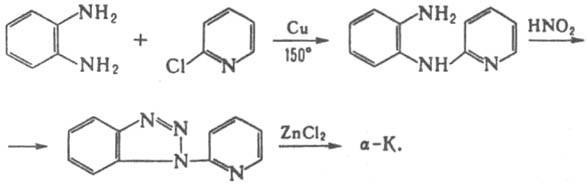
Разб. нейтральные р-ры a-К. обладают фиолетовой флуоресценцией, р-ры b-К. в кислых средах - синей, кислые спиртовые р-ры g-К. синевато-фиолетовой в УФ свете. К. обладают ароматич. св-вами. Пара электронов атома N индольного ядра включена в общую ароматич. p-систему, поэтому этот атом лишен основных св-в. Основные св-ва К. обусловлены лишь пиридиновым атомом N. С минер. к-тами К. образуют соли, с СН3I и (СН3)2SО4 - соли четвертичных аммониевых оснований, к-рые под действием оснований легко превращаются в ангидрооснования. N-Алкилирование по индольному атому N идет только после депротонирования его основаниями (d-К. в эту р-цию не вступает). Ацилирование b-К. по Шоттену-Бауману идет по индольному атому N. Незамещенные К. устойчивы к перегонке в токе Н2 над цинковой пылью. Восстановление b-К. действием Na в спирте приводит к 1,2,3,4-тетрагидро-b-К. Окислит. расщеплению подвергается бензольное кольцо в производных b- и g-К. С Н2О2, надбензойной и надуксусной к-тами b- и d-К. образуют N-оксиды по пиридиновому атому N. Нитрование К. приводит, как правило, к смеси мононитропроизводных с NO2-группой в положениях 6 и 8. При действии амида Na на b-К. образуется 1-аминопроизводное. Общий способ получения К, - взаимод. о-фенилендиамина с 2-, 3- или 4-хлорпиридином (метод Гребе-Ульмана), напр.:
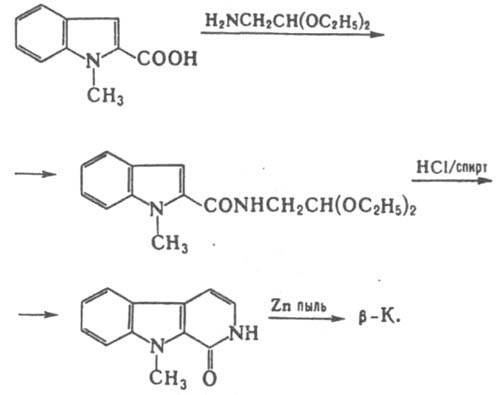
Смесь a- и g-К. получают термич. разложением 3-(2-азидофенил)пиридина; замещенные a-К. - циклизацией фенилгидразонов d-кетонитрилов, конденсацией 2-аминоиндолов с b-дикарбонильными соед.; b-К. - взаимод. триптамина или триптофана с формальдегидом (аналогично методу Пикте-Шпенглера для синтеза изохинолинов) или из 1-метилиндол-2-карбоновой к-ты по схеме:
В природе наиб. распространены производные b-К. (норгармана), ядро к-рого основа алкалоидов гармина, гармана, гармалина и др. Производные b- и g-К. гипотензивные лек. ср-ва, нейролептики, антидепрессанты, противогистаминные препараты. Лит.: Кермак В., Мак-Кейд Дж., в кн.: Гетероциклические соединения. под ред. Р. Эльдерфилда, пер. с англ., т. 7, М., 1965, с. 185-262; Abramovitch R. A., Spenser I. D., в кн. Advances in heterocyclic chemisry, ed. by A. R. Katritzky, v. 3, N.Y. L., 1964, p. 79-207 М. А. Юровская.

Разб. нейтральные р-ры a-К. обладают фиолетовой флуоресценцией, р-ры b-К. в кислых средах - синей, кислые спиртовые р-ры g-К. синевато-фиолетовой в УФ свете. К. обладают ароматич. св-вами. Пара электронов атома N индольного ядра включена в общую ароматич. p-систему, поэтому этот атом лишен основных св-в. Основные св-ва К. обусловлены лишь пиридиновым атомом N. С минер. к-тами К. образуют соли, с СН3I и (СН3)2SО4 - соли четвертичных аммониевых оснований, к-рые под действием оснований легко превращаются в ангидрооснования. N-Алкилирование по индольному атому N идет только после депротонирования его основаниями (d-К. в эту р-цию не вступает). Ацилирование b-К. по Шоттену-Бауману идет по индольному атому N. Незамещенные К. устойчивы к перегонке в токе Н2 над цинковой пылью. Восстановление b-К. действием Na в спирте приводит к 1,2,3,4-тетрагидро-b-К. Окислит. расщеплению подвергается бензольное кольцо в производных b- и g-К. С Н2О2, надбензойной и надуксусной к-тами b- и d-К. образуют N-оксиды по пиридиновому атому N. Нитрование К. приводит, как правило, к смеси мононитропроизводных с NO2-группой в положениях 6 и 8. При действии амида Na на b-К. образуется 1-аминопроизводное. Общий способ получения К, - взаимод. о-фенилендиамина с 2-, 3- или 4-хлорпиридином (метод Гребе-Ульмана), напр.:

Смесь a- и g-К. получают термич. разложением 3-(2-азидофенил)пиридина; замещенные a-К. - циклизацией фенилгидразонов d-кетонитрилов, конденсацией 2-аминоиндолов с b-дикарбонильными соед.; b-К. - взаимод. триптамина или триптофана с формальдегидом (аналогично методу Пикте-Шпенглера для синтеза изохинолинов) или из 1-метилиндол-2-карбоновой к-ты по схеме:

В природе наиб. распространены производные b-К. (норгармана), ядро к-рого основа алкалоидов гармина, гармана, гармалина и др. Производные b- и g-К. гипотензивные лек. ср-ва, нейролептики, антидепрессанты, противогистаминные препараты. Лит.: Кермак В., Мак-Кейд Дж., в кн.: Гетероциклические соединения. под ред. Р. Эльдерфилда, пер. с англ., т. 7, М., 1965, с. 185-262; Abramovitch R. A., Spenser I. D., в кн. Advances in heterocyclic chemisry, ed. by A. R. Katritzky, v. 3, N.Y. L., 1964, p. 79-207 М. А. Юровская.


