КАЛЬЦИТОНИН (тирсокальцитонин), пептидный гормон. Первичная структура К. человека:
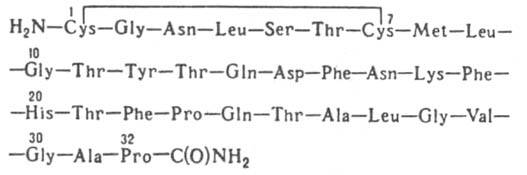
(мол. м. 3,6 тыс.; букв. обозначения см. в ст. Аминокислоты). Видовые различия в строении К. значительны (напр., К. человека отличается от свиного расположением 18 аминокислотных остатков). У разных организмов отличаются гл. обр. участки между аминокислотными остатками в положениях 10 и 32. Однако К. разл. видов сохраняют общую схему строения - имеют на N-конце дисульфидный мостик, связывающий остатки цистеина в положениях 1 и 7, и остаток амида пролина на С-конце. Для проявления биол. действия К. обязательно сохранение всей его пептидной цепи. Осуществлен хим. синтез К. человека и ряда животных. У большинства млекопитающих К. вырабатывается специализированными парафолликулярными клетками, или т. наз. С-клетками, щитовидной железы. У человека С-клетки обнаружены не только в щитовидной железе, но также в тимусе и легких. Биосинтез К. осуществляется путем протеолитич. расщепления прокальцитонина (мол. м. 21 тыс.). При этом наряду с К. образуется др. гормон - т. наз. катакальцин. Его полипептидная цепь (у человека состоит из 21 аминокислотного остатка) локализована на С-концевом участке прокальцитонина. У человека и крысы установлено строение гена К. Наряду с К. и катакальцином он кодирует третий регуляторный пептид - нейропептид, содержащий 31 аминокислотный остаток. Из 4 экзонов (участков ДНК, кодирующих пептиды), имеющихся в гене, два первых - общие для этих гормонов, третий кодирует К. и катакальцин, четвертый - нейропептид. К. участвует в регуляции обмена Са и Р. Действует в осн. на скелет, где тормозит резорбцию Са костной тканью. Является антагонистом паратгормона. Осн. физиол. роль К. - поддержание структуры скелета во время роста, беременности и лактации, когда потребность тканей в Са резко возрастает. К. выделяют из щитовидных желез животных или синтезируют. Практич. применение нашел К. лососей, биол. активность к-рого для человека значительно превосходит активность его собственного К. Применяют как ср-во, подавляющее резорбцию костей. Лит.: Булатов А. А., в кн.: Биохимия гормопов и гормональной регуляции, М., 1976, с. 126-44; Скрябин К. Г., "Ж. Всес. хим. об-ва им. Д. И. Менделеева", 1984, т. 29, № 2, с. 75-84; Maclntyre I. [а.о.], "Nature", 1982, v. 300, р. 460-62; Maclntyre I, "Triangle", 1983, v. 22, № 2-3. p. 69 74. А. А. Булатов.

(мол. м. 3,6 тыс.; букв. обозначения см. в ст. Аминокислоты). Видовые различия в строении К. значительны (напр., К. человека отличается от свиного расположением 18 аминокислотных остатков). У разных организмов отличаются гл. обр. участки между аминокислотными остатками в положениях 10 и 32. Однако К. разл. видов сохраняют общую схему строения - имеют на N-конце дисульфидный мостик, связывающий остатки цистеина в положениях 1 и 7, и остаток амида пролина на С-конце. Для проявления биол. действия К. обязательно сохранение всей его пептидной цепи. Осуществлен хим. синтез К. человека и ряда животных. У большинства млекопитающих К. вырабатывается специализированными парафолликулярными клетками, или т. наз. С-клетками, щитовидной железы. У человека С-клетки обнаружены не только в щитовидной железе, но также в тимусе и легких. Биосинтез К. осуществляется путем протеолитич. расщепления прокальцитонина (мол. м. 21 тыс.). При этом наряду с К. образуется др. гормон - т. наз. катакальцин. Его полипептидная цепь (у человека состоит из 21 аминокислотного остатка) локализована на С-концевом участке прокальцитонина. У человека и крысы установлено строение гена К. Наряду с К. и катакальцином он кодирует третий регуляторный пептид - нейропептид, содержащий 31 аминокислотный остаток. Из 4 экзонов (участков ДНК, кодирующих пептиды), имеющихся в гене, два первых - общие для этих гормонов, третий кодирует К. и катакальцин, четвертый - нейропептид. К. участвует в регуляции обмена Са и Р. Действует в осн. на скелет, где тормозит резорбцию Са костной тканью. Является антагонистом паратгормона. Осн. физиол. роль К. - поддержание структуры скелета во время роста, беременности и лактации, когда потребность тканей в Са резко возрастает. К. выделяют из щитовидных желез животных или синтезируют. Практич. применение нашел К. лососей, биол. активность к-рого для человека значительно превосходит активность его собственного К. Применяют как ср-во, подавляющее резорбцию костей. Лит.: Булатов А. А., в кн.: Биохимия гормопов и гормональной регуляции, М., 1976, с. 126-44; Скрябин К. Г., "Ж. Всес. хим. об-ва им. Д. И. Менделеева", 1984, т. 29, № 2, с. 75-84; Maclntyre I. [а.о.], "Nature", 1982, v. 300, р. 460-62; Maclntyre I, "Triangle", 1983, v. 22, № 2-3. p. 69 74. А. А. Булатов.


