ИНДИКАТОРЫ (позднелат. indicator - указатель), хим. в-ва, изменяющие окраску, люминесценцию или образующие осадок при изменении концентрации к.-л. компонента в р-ре. Указывают на определенное состояние системы или на момент достижения этого состояния.
Различают И. обратимые и необратимые. Изменение окраски первых при изменении состояния системы (напр., фенолфталеина при изменении рН среды) м. б. повторено многократно. Необратимые И. подвергаются необратимым хим. превращениям, напр., азосоединения при окислении ионами BrO3- разрушаются. Индикаторы, к-рые вводят в исследуемый р-р, наз. внутренними, в отличие от внешних, р-цию с к-рыми проводят вне анализируемой смеси. В последнем случае одну или неск. капель анализируемого р-ра помещают на бумажку, пропитанную И., или смешивают их на белой фарфоровой пластинке с каплей индикатора.
И. применяют чаще всего для установления конца к.-л. хим. р-ции, гл. обр. конечной точки титрования (к. т. т.). В соответствии с титриметрич. методами различают кислотно-основные, адсорбц., окислит.-восстановит. и комплексонометрич. И.
Кислотно-основные И. представляют собой р-римые орг соед., к-рые меняют свой цвет или люминесценцию в зависимости от концентрации ионов Н+ (рН среды). Примен. для установления конца р-ции между к-тами и основаниями (в т. ч. при кислотно-основном титровании) или др. р-ций, если в них участвуют ионы Н+, а также для колориметрич. определения рН водных р-ров. Наиб. важные кислотно-основные И. приведены в табл. 1. Причина изменения цвета И. в том, что присоединение или отдача протонов его молекулами связаны с заменой одних хромофорных групп другими или с появлением новых хромофорных групп.
Если И. слабая к-та HIn, то в водном р-ре имеет место равновесие: HIn + Н2О D In- + Н3О+ . Если И. - слабое основание In, то: In + H2O D HIn+ + ОН-. В общем виде можно записать: Ina + Н2О D Inb + Н3О+, где Ina и Inb - соотв. кислая и основная формы И., к-рые окрашены различно. Константа равновесия этого процесса Кln = [Inb][H3O+]/[Ina] наз. константой И. Цвет р-ра зависит от соотношения [Ina]/[Inb], к-рое определяется рН р-ра.
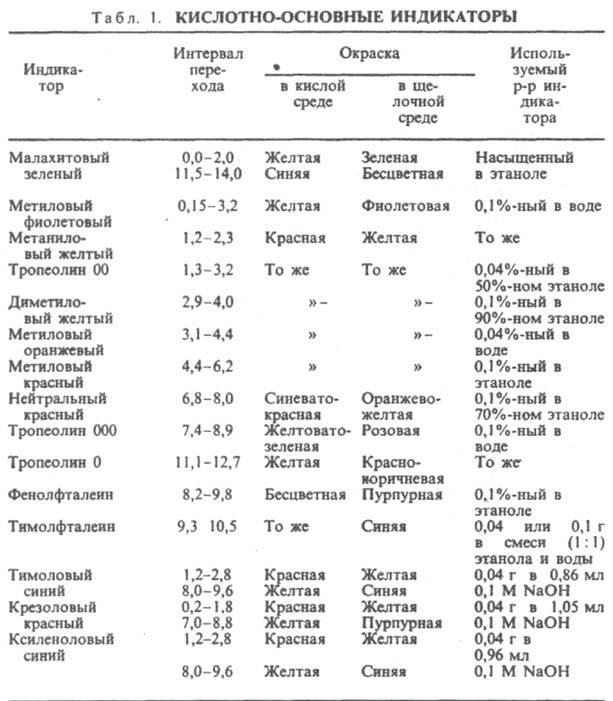
Считают, что цвет одной формы И. заметен, если ее концентрация в 10 раз превышает концентрацию др. формы, т.е. если отношение [Ina]/[Inb] = [H3O+]/Kln равно 0,1 или 10. Изменение цвета И. отмечается в области рН = рКlп b 1, к-рый наз. интервалом перехода И. Изменение наиб. отчетливо, когда [Ina] = [Inb] и Кln = [Н3О]+, т.е. при рН = рКln. Значение рН, при к-ром обычно заканчивается титрование, наз. показателем титрования рТ. И. для титрования подбирают таким образом, чтобы интервал перехода окраски включал значение рН, какое должен иметь р-р в точке эквивалентности. Часто это значение рН не совпадает с рТ используемого индикатора, что приводит к т. наз. индикаторной ошибке. Если в к. т. т. остается избыток неоттитрованного слабого основания или к-ты, ошибка наз. соотв. основной или кислотной. Чувствительность И. - концентрация (в моль/л) определяемого иона (в данном случае Н+ или ОН- ) в точке наиб. резкого перехода окраски. Различают: чувствительные к к-там И. с интервалом перехода в области щелочных значений рН (напр., фенолфталеин, тимолфталеин); чувствительные к основаниям И. с интервалом перехода в кислой области (как у диметилового желтого, метилового оранжевого и др.); нейтральные И., интервал перехода к-рых находится ок. рН 7 (нейтральный красный, феноловый красный и др.). И. бывают с одной или двумя окрашенными формами; такие И. наз. соотв. одноцветными и двухцветными. Наиб. четкое изменение окраски наблюдалось бы у тех И., кислотная и основная формы к-рых окрашены в дополнит. цвета. Однако таких И. не существует. Поэтому, добавляя краситель, изменяют соответствующим образом окраски обеих форм. Так, у метилового красного переход от красного к желтому происходит в интервале 2 единиц рН, а если к р-ру добавить метиленовый синий, то переход окраски от красно-фиолетовой к зеленой наблюдается резко и отчетливо при рН 5,3. Подобного эффекта можно добиться, если использовать смесь двух индикаторов, цвета к-рых дополняют дру. друга. Такие И. наз. смешанными (табл. 2).

Смеси И., к-рые непрерывно изменяют свой цвет во всей области значений рН от 1 до 14, наз. универсальными. Их используют для приблизит. оценки рН р-ров. На изменение окраски И. оказывают влияние его концентрации. Для двухцветных И. чем выше концентрация, тем изменение окраски менее резко, т.к. спектры поглощения обеих форм накладываются друг на друга в большей степени и становится труднее определить изменение окраски. Обычно используют одно и то же минимальное (неск. капель р-ра) кол-во И. Интервал перехода многих И. зависит от т-ры. Так, метиловый оранжевый меняет свою окраску при комнатной т-ре в интервале рН 3,4-4,4, а при 100 °С в интервале рН 2,5-3,3. Это связано с изменением ионного произведения воды. Присутствующие в р-ре коллоидные частицы адсорбируют И., что приводит к полному изменению его цвета. Для исключения ошибки в присут. положительно заряженных коллоидных частиц следует применять И.-основания, а в присут. отрицательно заряженных - И.-кислоты. При титровании в обычных условиях необходимо учитывать влияние растворенного СО2, особенно при использовании И. с рКln > 4 (напр., метилового оранжевого, метилового красного, фенолфталеина). Иногда СО2 предварительно удаляют кипячением или титруют р-р в отсутствие контакта с атмосферой. Влияние посторонних нейтральных электролитов (солевой эффект) проявляется в смещении равновесия И. В случае И.-кислот интервал перехода смещается в более кислую область, а в случае И.-оснований - в более щелочную. В зависимости от природы р-рителя меняются окраски И., их рКln и чувствительность. Так, метиловый красный в воде дает переход окраски при более высоких значениях активности ионов Н+ , чем бромфеноловый синий, а в этиленгликолевом р-ре наоборот. В водно-метанольных и водно-этанольных р-рах изменение по сравнению с водной средой незначительно. В спиртовой среде И.-кислоты более чувствительны к ионам Н+ , чем И.-основания. Хотя при титровании в неврдных средах обычно к. т. т. устанавливают потенциометрически с помощью стеклянного индикаторного электрода, используют также кислотно-основные И. (табл. 3). Чаще всего для титрования слабых оснований применяют метиловый красный в диоксане или кристаллический фиолетовый в безводной СН3СООН; при титровании слабых к-т - тимоловый синий в ДМФА. Поведение И. в неводной и водной средах аналогично. Напр., для слабой к-ты HIn в р-рителе SН можно записать равновесие: HIn + SH D In- + SH2+. Механизм действия И. такой же, как и в воде, только в неводных средах пользуются соответствующими шкалами кислотности (рНр, рА; см. Кислотно-основное титрование). В качестве кислотно-основных И. используют также люминесцентные индикаторы, меняющие цвет и интенсивность флуоресценции в зависимости от рН и позволяющие титровать сильно окрашенные и мутные р-ры.

Для титрования слабых к-т применяются т наз. индикаторы помутнения в-ва, образующие обратимые коллоидные системы, коагулирующие в очень узком интервале рН (напр., изонитроацетил-n-аминобензол дает муть при рН 10,7-11,0). В качестве кислотно-основных И. можно использовать комплексы металлов с металлохромными индикаторами (см. ниже); эти комплексы, разрушаясь, изменяют окраску р-ра в узком интервале рН. Для определения орг. к-т и оснований в воде в присут. несмешивающегося с ней р-рителя применяют т. наз. амфииндикаторы, к-рые представляют собой соли И.-кислот (напр., тропеолина 00) с разл. орг. основаниями (напр., алкалоидами). Эти И. хорошо раств. в орг. р-рителях, плохо в воде; отличаются высокой чувствительностью. Адсорбционные И. в-ва, способные адсорбироваться на пов-сти осадка и менять при этом окраску или интенсивность люминесценции Эти И., как правило, обратимы и используются в осадительном титровании В первую очередь осадком адсорбируются ионы, идентичные тем, к-рые входят в состав самого осадка, после чего адсорбируется И. Большая группа И. красители (табл. 4), адсорбирующиеся пов-стью осадка с образованием солей с ионами, содержащимися в осадке.

Напр., р-р эозина розового цвета, к-рый не меняется при добавлении AgNO3. Но при титровании р-ром КВr выпадающий осадок адсорбирует ионы Ag+, к-рые присоединяют к себе анионы эозина. Осадок при этом становится красно-фиолетовым. В к. т. т., когда оттитрованы все ионы Ag+, окраска осадка исчезает и р-р становится снова розовым. Неорг. адсорбц. И. образуют с ионами титранта цветной осадок или комплекс (как, напр., применяемые в качестве индикаторов ионы СrО4- и SCN- в аргентометрии). В качестве адсорбц. И. применяются также нек-рые кислотно-основные, окислит.-восстановит. и комплексонометрич. индикаторы, св-ва к-рых (константы кислотной диссоциации, окислит.-восстановит. потенциалы и константы устойчивости комплексов с катионами металлов) в адсорбир. состоянии зависят от природы и концентрации ионов на пов-сти осадка. Окислит.-восстановит. И. - в-ва, способные изменять окраску в зависимости от окислит.-восстановит. потенциала р-ра. Применяют для установления к. т. т. окислит.-восстановит. титрования и для колориметрич. определения окислит.-восстановит. потенциала (преим. в биологии). Такими И. служат, как правило, в-ва, к-рые сами подвергаются окислению или восстановлению, причем окисленная (InOх) и восстановленная (InRed) формы имеют разные окраски. Для обратимых окислит.-восстановит. И. можно записать: InOх + ne D InRed , где п - число электронов. При потенциале Е отношение концентраций обеих форм И. определяется Нернста уравнением:
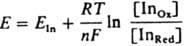 ,
,
где Eln - реальный окислит.-восстановит. потенциал индикатора, зависящий от состава р-ра. Интервал перехода окраски практически наблюдается при изменении отношения [In0x]/[InRed] от 0,1 до 10, что при 25 °С соответствует DE (в В) = Eln b (0,059/n). Потенциал, соответствующий самому резкому изменению цвета, равен Eln. При выборе И. учитывают гл. обр. значения Eln, коэф. молярного погашения обеих форм И. и потенциал р-ра в точке эквивалентности. При титровании сильными окислителями (К2Сr2О7, КМnО4 и др.) применяют И., имеющие сравнительно высокие Eln, напр., дифениламин и его производные; при титровании сильными восстановителями [солями Ti(III), V(II) и т.д.] применяют И. с относительно низкими Eln, напр., сафранин, метиленовый голубой (табл. 5).
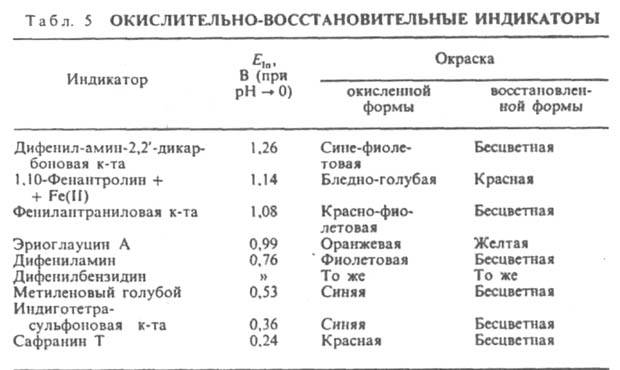
Нек-рые в-ва изменяют свою окраску необратимо, напр., при окислении разрушаются с образованием бесцв. продуктов, как индиго под действием гипохлоритов или нафтоловый сине-черный под действием ионов ВrО3. Комплексонометрические И. - в-ва, образующие с ионами металлов (М) окрашенные комплексы, по цвету отличающиеся от самих И. Применяются для установления к. т. т. в комплексонометрии. Устойчивость комплексов металлов с И. (In) меньше, чем соответствующих комплексoнатов, поэтому в к. т. т. комплексоны вытесняют И. из комплексов с металлами. В момент изменения окраски в точке эквивалентности [In] = [MIn] и, следовательно, рМ = — lg KMln, где рМ = — lg[M] наз. точкой перехода И., КMln - константа устойчивости комплекса металла с И. Ошибка при титровании связана с тем, что нек-рое кол-во иона металла может присоединяться к И., а не к титранту. Наиб. часто используют т. наз. металлохромные И. (табл. 6) - орг. в-ва, образующие с катионами металлов р-римые в воде интенсивно окрашенные (el 104-105) внутрикомплексные соединения. Эти соед. должны быть достаточно устойчивы, чтобы образовываться при очень низких концентрациях ионов металлов. Индикатор и его комплекс должны находиться в истинном р-ре. Дня повышения р-римости реагента и комплекса обычно вводят смешивающийся с водой р-ритель. Комплекс металла с И. должен быть лабильным и быстро разрушаться под действием комплексона. Различают селективные и универсальные металлохромные И., взаимодействующие соотв. с небольшим числом или с мн. катионами. К первым относятся, напр., тайрон, галлион, ко вторым - арсеназо I, пиридилазонафтол (ПАН), пирокатехиновый фиолетовый, ксиленоловый оранжевый, метилтимоловый синий, хромазурол и др.

Иногда в качестве комплексонометрич. И. применяют комплексонат к.-л. иона (напр., [CuY]2- , где Y - анион этилендиаминтетрауксусной к-ты) в смеси с металлохромным И., напр. ПАН. При введении определяемого иона М2+ происходит р-ция: М2+ + [CuY]2- + ПАН D [MY]2- + [СuПАН]+. При титровании к.-л. комплексоном в к. т. т. окраска р-ра меняется от фиолетовой к желто-оранжевой, т.е. очень контрастно. При комплексонометрич. определении Сu используют в качестве индикатора ее комплекс с ПАН, адсорбированный на пов-сти осажденного AgI. В этом случае можно определять Ag и Сu при совместном присутствии: в кислой среде р-ром KI оттитровывают сначала ионы Ag, а затем комплексоном - ионы Сu. Применяются также т. наз. неокрашенные комплексонометрич. И., избирательно взаимодействующие с ионами определяемого металла с образованием слабо окрашенных (el 103) комплексов, напр., сульфосалициловая кислота при титровании Fe (III). Флуоресцентные комплексонометрич. И. (или металлофлуоресцентные И.) взаимод. с катионами металлов с образованием интенсивно флуоресцирующих хелатов (см. Люминесцентные индикаторы). Впервые об И. сообщил англ. физик и химик Р. Бойль в 1664. О применении И. на носителях см. Реактивные индикаторные бумаги и Индикаторные трубки. Лит.: Индикаторы, пер. с англ., т. 1-2, М., 1976; Денеш И., Титрование в неводных средах, пер. с англ., М., 1971; Коренман И. М., Новые титриметрические методы, М., 1983. Л. Н. Симонова.

Считают, что цвет одной формы И. заметен, если ее концентрация в 10 раз превышает концентрацию др. формы, т.е. если отношение [Ina]/[Inb] = [H3O+]/Kln равно 0,1 или 10. Изменение цвета И. отмечается в области рН = рКlп b 1, к-рый наз. интервалом перехода И. Изменение наиб. отчетливо, когда [Ina] = [Inb] и Кln = [Н3О]+, т.е. при рН = рКln. Значение рН, при к-ром обычно заканчивается титрование, наз. показателем титрования рТ. И. для титрования подбирают таким образом, чтобы интервал перехода окраски включал значение рН, какое должен иметь р-р в точке эквивалентности. Часто это значение рН не совпадает с рТ используемого индикатора, что приводит к т. наз. индикаторной ошибке. Если в к. т. т. остается избыток неоттитрованного слабого основания или к-ты, ошибка наз. соотв. основной или кислотной. Чувствительность И. - концентрация (в моль/л) определяемого иона (в данном случае Н+ или ОН- ) в точке наиб. резкого перехода окраски. Различают: чувствительные к к-там И. с интервалом перехода в области щелочных значений рН (напр., фенолфталеин, тимолфталеин); чувствительные к основаниям И. с интервалом перехода в кислой области (как у диметилового желтого, метилового оранжевого и др.); нейтральные И., интервал перехода к-рых находится ок. рН 7 (нейтральный красный, феноловый красный и др.). И. бывают с одной или двумя окрашенными формами; такие И. наз. соотв. одноцветными и двухцветными. Наиб. четкое изменение окраски наблюдалось бы у тех И., кислотная и основная формы к-рых окрашены в дополнит. цвета. Однако таких И. не существует. Поэтому, добавляя краситель, изменяют соответствующим образом окраски обеих форм. Так, у метилового красного переход от красного к желтому происходит в интервале 2 единиц рН, а если к р-ру добавить метиленовый синий, то переход окраски от красно-фиолетовой к зеленой наблюдается резко и отчетливо при рН 5,3. Подобного эффекта можно добиться, если использовать смесь двух индикаторов, цвета к-рых дополняют дру. друга. Такие И. наз. смешанными (табл. 2).

Смеси И., к-рые непрерывно изменяют свой цвет во всей области значений рН от 1 до 14, наз. универсальными. Их используют для приблизит. оценки рН р-ров. На изменение окраски И. оказывают влияние его концентрации. Для двухцветных И. чем выше концентрация, тем изменение окраски менее резко, т.к. спектры поглощения обеих форм накладываются друг на друга в большей степени и становится труднее определить изменение окраски. Обычно используют одно и то же минимальное (неск. капель р-ра) кол-во И. Интервал перехода многих И. зависит от т-ры. Так, метиловый оранжевый меняет свою окраску при комнатной т-ре в интервале рН 3,4-4,4, а при 100 °С в интервале рН 2,5-3,3. Это связано с изменением ионного произведения воды. Присутствующие в р-ре коллоидные частицы адсорбируют И., что приводит к полному изменению его цвета. Для исключения ошибки в присут. положительно заряженных коллоидных частиц следует применять И.-основания, а в присут. отрицательно заряженных - И.-кислоты. При титровании в обычных условиях необходимо учитывать влияние растворенного СО2, особенно при использовании И. с рКln > 4 (напр., метилового оранжевого, метилового красного, фенолфталеина). Иногда СО2 предварительно удаляют кипячением или титруют р-р в отсутствие контакта с атмосферой. Влияние посторонних нейтральных электролитов (солевой эффект) проявляется в смещении равновесия И. В случае И.-кислот интервал перехода смещается в более кислую область, а в случае И.-оснований - в более щелочную. В зависимости от природы р-рителя меняются окраски И., их рКln и чувствительность. Так, метиловый красный в воде дает переход окраски при более высоких значениях активности ионов Н+ , чем бромфеноловый синий, а в этиленгликолевом р-ре наоборот. В водно-метанольных и водно-этанольных р-рах изменение по сравнению с водной средой незначительно. В спиртовой среде И.-кислоты более чувствительны к ионам Н+ , чем И.-основания. Хотя при титровании в неврдных средах обычно к. т. т. устанавливают потенциометрически с помощью стеклянного индикаторного электрода, используют также кислотно-основные И. (табл. 3). Чаще всего для титрования слабых оснований применяют метиловый красный в диоксане или кристаллический фиолетовый в безводной СН3СООН; при титровании слабых к-т - тимоловый синий в ДМФА. Поведение И. в неводной и водной средах аналогично. Напр., для слабой к-ты HIn в р-рителе SН можно записать равновесие: HIn + SH D In- + SH2+. Механизм действия И. такой же, как и в воде, только в неводных средах пользуются соответствующими шкалами кислотности (рНр, рА; см. Кислотно-основное титрование). В качестве кислотно-основных И. используют также люминесцентные индикаторы, меняющие цвет и интенсивность флуоресценции в зависимости от рН и позволяющие титровать сильно окрашенные и мутные р-ры.

Для титрования слабых к-т применяются т наз. индикаторы помутнения в-ва, образующие обратимые коллоидные системы, коагулирующие в очень узком интервале рН (напр., изонитроацетил-n-аминобензол дает муть при рН 10,7-11,0). В качестве кислотно-основных И. можно использовать комплексы металлов с металлохромными индикаторами (см. ниже); эти комплексы, разрушаясь, изменяют окраску р-ра в узком интервале рН. Для определения орг. к-т и оснований в воде в присут. несмешивающегося с ней р-рителя применяют т. наз. амфииндикаторы, к-рые представляют собой соли И.-кислот (напр., тропеолина 00) с разл. орг. основаниями (напр., алкалоидами). Эти И. хорошо раств. в орг. р-рителях, плохо в воде; отличаются высокой чувствительностью. Адсорбционные И. в-ва, способные адсорбироваться на пов-сти осадка и менять при этом окраску или интенсивность люминесценции Эти И., как правило, обратимы и используются в осадительном титровании В первую очередь осадком адсорбируются ионы, идентичные тем, к-рые входят в состав самого осадка, после чего адсорбируется И. Большая группа И. красители (табл. 4), адсорбирующиеся пов-стью осадка с образованием солей с ионами, содержащимися в осадке.

Напр., р-р эозина розового цвета, к-рый не меняется при добавлении AgNO3. Но при титровании р-ром КВr выпадающий осадок адсорбирует ионы Ag+, к-рые присоединяют к себе анионы эозина. Осадок при этом становится красно-фиолетовым. В к. т. т., когда оттитрованы все ионы Ag+, окраска осадка исчезает и р-р становится снова розовым. Неорг. адсорбц. И. образуют с ионами титранта цветной осадок или комплекс (как, напр., применяемые в качестве индикаторов ионы СrО4- и SCN- в аргентометрии). В качестве адсорбц. И. применяются также нек-рые кислотно-основные, окислит.-восстановит. и комплексонометрич. индикаторы, св-ва к-рых (константы кислотной диссоциации, окислит.-восстановит. потенциалы и константы устойчивости комплексов с катионами металлов) в адсорбир. состоянии зависят от природы и концентрации ионов на пов-сти осадка. Окислит.-восстановит. И. - в-ва, способные изменять окраску в зависимости от окислит.-восстановит. потенциала р-ра. Применяют для установления к. т. т. окислит.-восстановит. титрования и для колориметрич. определения окислит.-восстановит. потенциала (преим. в биологии). Такими И. служат, как правило, в-ва, к-рые сами подвергаются окислению или восстановлению, причем окисленная (InOх) и восстановленная (InRed) формы имеют разные окраски. Для обратимых окислит.-восстановит. И. можно записать: InOх + ne D InRed , где п - число электронов. При потенциале Е отношение концентраций обеих форм И. определяется Нернста уравнением:
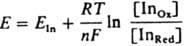 ,
, где Eln - реальный окислит.-восстановит. потенциал индикатора, зависящий от состава р-ра. Интервал перехода окраски практически наблюдается при изменении отношения [In0x]/[InRed] от 0,1 до 10, что при 25 °С соответствует DE (в В) = Eln b (0,059/n). Потенциал, соответствующий самому резкому изменению цвета, равен Eln. При выборе И. учитывают гл. обр. значения Eln, коэф. молярного погашения обеих форм И. и потенциал р-ра в точке эквивалентности. При титровании сильными окислителями (К2Сr2О7, КМnО4 и др.) применяют И., имеющие сравнительно высокие Eln, напр., дифениламин и его производные; при титровании сильными восстановителями [солями Ti(III), V(II) и т.д.] применяют И. с относительно низкими Eln, напр., сафранин, метиленовый голубой (табл. 5).

Нек-рые в-ва изменяют свою окраску необратимо, напр., при окислении разрушаются с образованием бесцв. продуктов, как индиго под действием гипохлоритов или нафтоловый сине-черный под действием ионов ВrО3. Комплексонометрические И. - в-ва, образующие с ионами металлов (М) окрашенные комплексы, по цвету отличающиеся от самих И. Применяются для установления к. т. т. в комплексонометрии. Устойчивость комплексов металлов с И. (In) меньше, чем соответствующих комплексoнатов, поэтому в к. т. т. комплексоны вытесняют И. из комплексов с металлами. В момент изменения окраски в точке эквивалентности [In] = [MIn] и, следовательно, рМ = — lg KMln, где рМ = — lg[M] наз. точкой перехода И., КMln - константа устойчивости комплекса металла с И. Ошибка при титровании связана с тем, что нек-рое кол-во иона металла может присоединяться к И., а не к титранту. Наиб. часто используют т. наз. металлохромные И. (табл. 6) - орг. в-ва, образующие с катионами металлов р-римые в воде интенсивно окрашенные (el 104-105) внутрикомплексные соединения. Эти соед. должны быть достаточно устойчивы, чтобы образовываться при очень низких концентрациях ионов металлов. Индикатор и его комплекс должны находиться в истинном р-ре. Дня повышения р-римости реагента и комплекса обычно вводят смешивающийся с водой р-ритель. Комплекс металла с И. должен быть лабильным и быстро разрушаться под действием комплексона. Различают селективные и универсальные металлохромные И., взаимодействующие соотв. с небольшим числом или с мн. катионами. К первым относятся, напр., тайрон, галлион, ко вторым - арсеназо I, пиридилазонафтол (ПАН), пирокатехиновый фиолетовый, ксиленоловый оранжевый, метилтимоловый синий, хромазурол и др.

Иногда в качестве комплексонометрич. И. применяют комплексонат к.-л. иона (напр., [CuY]2- , где Y - анион этилендиаминтетрауксусной к-ты) в смеси с металлохромным И., напр. ПАН. При введении определяемого иона М2+ происходит р-ция: М2+ + [CuY]2- + ПАН D [MY]2- + [СuПАН]+. При титровании к.-л. комплексоном в к. т. т. окраска р-ра меняется от фиолетовой к желто-оранжевой, т.е. очень контрастно. При комплексонометрич. определении Сu используют в качестве индикатора ее комплекс с ПАН, адсорбированный на пов-сти осажденного AgI. В этом случае можно определять Ag и Сu при совместном присутствии: в кислой среде р-ром KI оттитровывают сначала ионы Ag, а затем комплексоном - ионы Сu. Применяются также т. наз. неокрашенные комплексонометрич. И., избирательно взаимодействующие с ионами определяемого металла с образованием слабо окрашенных (el 103) комплексов, напр., сульфосалициловая кислота при титровании Fe (III). Флуоресцентные комплексонометрич. И. (или металлофлуоресцентные И.) взаимод. с катионами металлов с образованием интенсивно флуоресцирующих хелатов (см. Люминесцентные индикаторы). Впервые об И. сообщил англ. физик и химик Р. Бойль в 1664. О применении И. на носителях см. Реактивные индикаторные бумаги и Индикаторные трубки. Лит.: Индикаторы, пер. с англ., т. 1-2, М., 1976; Денеш И., Титрование в неводных средах, пер. с англ., М., 1971; Коренман И. М., Новые титриметрические методы, М., 1983. Л. Н. Симонова.


