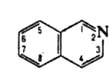
ИЗОХИНОЛИН (бензо [с] пиридин), мол. м. 129,16; бесцв. гигроскопичная жидкость: т. пл. 26,5°С, т. кип. 243,25 °С, 117-118°С/17 мм рт. ст.; d425 1,0990; nD25 1,6208; m 6,81.10-30 Кл.м (бензол); h 46,28 Н/м (26,8 °С); DH0пл 0,724 кДж/моль, DH0сгор -6091 кДж/моль; рКа 5,40 (вода, 20 °С); трудно раств. в холодной воде, легко - в орг. р-рителях.
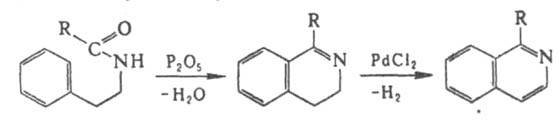
И. более сильное основание, чем хинолин. При протонировании атома N И. легко образует соли изохинолиния; с алкил-, ацил-, арилгалогенидами и диметилсульфатом образует соответствующие четвертичные соли. При гидрировании над Pt превращ. в 1,2,3,4-тетрагидроизохинолин, при полном гидрировании - в цис-декагидроизохинолин. Окисление в жидкой или газовой фазе, напр., смесью О3 и О2, приводит к пиридин-3,4-дикарбоновой и фталевой к-там, окисление надкислотами - к изохинолин-N-оксиду. Атака электроф. агентов направляется преим. в положение 5. Бромироваиие протекает обычно в присут. АlСl3, нитрование - под действием смеси HNO3 и H2SO4. При сульфировании олеумом, содержащим / 40% SO3, при т-ре 180°С основной продукт - изохинолин-8-сульфокислота; сульфирование 60%-ной H2SO4 при 300 °С приводит к смеси изохинолин-5- и изохинолин-8-сульфокислот. Высокотемпературное бромирование, протекающее, по-видимому, по радикальному механизму, идет с образованием 1-бромизохинолина. Нуклеоф. замещение протекает гл. обр. в положение 1 : с КОН при 220 °С образуется 1-гидроксиизохинолин, с NaNH2 - 1-аминоизохинолин. И. выделяют из продуктов дистилляции кам.-уг. смолы. Методы синтеза И. и его производных: 1) по Бишлера - Напиральского реакции:
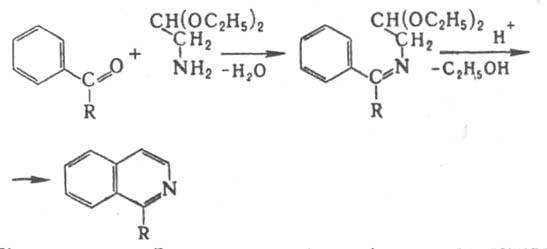
2) конденсацией ацетофенона с a-аминоацетацеталем (метод Померанца-Фрича):
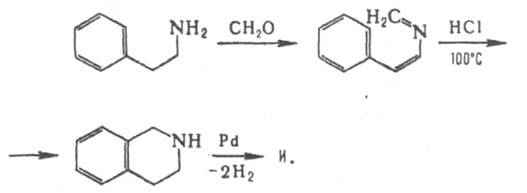
3) нагреванием 2-арилэтиламина с избытком альдегида в присут. сильных к-т; образующееся основание Шиффа циклизуется в тетрагидроизохинолин (метод Пикте-Шпенглера):
И. - исходный продукт при синтезе сенсибилизирующих красителей (напр., изохинолинового красного) и лек. ср-в. Ядро И. входит в состав изохинолиновых алкалоидов. Лит.: Генслер В. Дж., в кн.: Органические реакции, пер. с англ., т. 6, М., 1959, с. 218-29; его же, в кн.: Гетероциклические соединения, под ред. Р. Эльдерфилда, пер. с англ., т. 4, М.. 1955. с.264-358; Общая органическая химия, пер. с англ., т. 8. М., 1985. с. 255-86; Ullmanns Encyklopidie, 4 Аufl, Bd. 9, Weinheim, 1975. S. 311-12. И. В. Хвостов.

И. более сильное основание, чем хинолин. При протонировании атома N И. легко образует соли изохинолиния; с алкил-, ацил-, арилгалогенидами и диметилсульфатом образует соответствующие четвертичные соли. При гидрировании над Pt превращ. в 1,2,3,4-тетрагидроизохинолин, при полном гидрировании - в цис-декагидроизохинолин. Окисление в жидкой или газовой фазе, напр., смесью О3 и О2, приводит к пиридин-3,4-дикарбоновой и фталевой к-там, окисление надкислотами - к изохинолин-N-оксиду. Атака электроф. агентов направляется преим. в положение 5. Бромироваиие протекает обычно в присут. АlСl3, нитрование - под действием смеси HNO3 и H2SO4. При сульфировании олеумом, содержащим / 40% SO3, при т-ре 180°С основной продукт - изохинолин-8-сульфокислота; сульфирование 60%-ной H2SO4 при 300 °С приводит к смеси изохинолин-5- и изохинолин-8-сульфокислот. Высокотемпературное бромирование, протекающее, по-видимому, по радикальному механизму, идет с образованием 1-бромизохинолина. Нуклеоф. замещение протекает гл. обр. в положение 1 : с КОН при 220 °С образуется 1-гидроксиизохинолин, с NaNH2 - 1-аминоизохинолин. И. выделяют из продуктов дистилляции кам.-уг. смолы. Методы синтеза И. и его производных: 1) по Бишлера - Напиральского реакции:

2) конденсацией ацетофенона с a-аминоацетацеталем (метод Померанца-Фрича):

3) нагреванием 2-арилэтиламина с избытком альдегида в присут. сильных к-т; образующееся основание Шиффа циклизуется в тетрагидроизохинолин (метод Пикте-Шпенглера):

И. - исходный продукт при синтезе сенсибилизирующих красителей (напр., изохинолинового красного) и лек. ср-в. Ядро И. входит в состав изохинолиновых алкалоидов. Лит.: Генслер В. Дж., в кн.: Органические реакции, пер. с англ., т. 6, М., 1959, с. 218-29; его же, в кн.: Гетероциклические соединения, под ред. Р. Эльдерфилда, пер. с англ., т. 4, М.. 1955. с.264-358; Общая органическая химия, пер. с англ., т. 8. М., 1985. с. 255-86; Ullmanns Encyklopidie, 4 Аufl, Bd. 9, Weinheim, 1975. S. 311-12. И. В. Хвостов.


