ЗАНДМЕЙЕРА РЕАКЦИЯ, замена диазониевой группы в ароматич. солях диазония на галоген или псевдогалоген в присут. солей Cu(I), напр.:
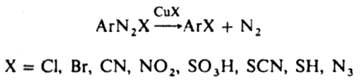
Для введения хлора или брома р-р соли диазония обычно добавляют при 0-35 °С к р-ру галогенида Cu(I) (от 0,1 до 1 моля на 1 моль диазосоединения) в галогеноводородной к-те. Выходы галогснидов 70-95%. Вместо солей меди можно применять порошок меди (р-ция Гаттермана) или соли др. металлов (напр., FeCl2). Иногда стадии диазотирования и замены диазониевой группы на галоген осуществляют без выделения промежут. продукта. Для введения нитрильной группы р-р соли диазония нейтрализуют, смешивают при охлаждении с р-ром комплексной соли Na [Сu (CN)2] или К [Сu (CN)2], затем нагревают. Выходы нитрилов обычно выше 60%. Скорость 3. р. увеличивается при введении электроноакцепторных и уменьшается при введении электронодонорных заместителей в ароматическое ядро. Побочные продукты при этой реакции - азосоединения, биарилы и фенолы. Предполагаемый механизм замены диазогруппы на галоген включает образование лабильного комплекса диазоний-катиона с солью Cu(I) (лимитирующая стадия), напр.:
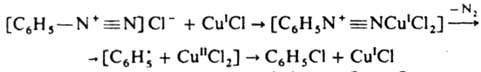
В ряду нафталина, фенантрена, бифенила 3. р. обычно дает низкие выходы галогенидов; в этих случаях используют термич. разложение двойных галогенидов диазония и ртути [ArN2]+ [HgHal3]- (р-ция Швехтена). Арилиодиды обычно получают нагреванием диазосоединений с р-ром KI, арилфториды - по Шимана реакции. 3. р. используют для пром. синтеза промежут. продуктов в произ-ве орг. красителей, напр. 8-хлор- и 8-цианонафталин-1-сульфокислот, хлортолуолов, 2-цианофенилтиогликолевых к-т. Р-ция открыта Т. Зандмейером в 1884. Лит.: Эфрос Л. С., Горелик М. В., Химия и технология промежуточных продукгов. Л., 1980. с. 334-40. Е. М. Рохлин.
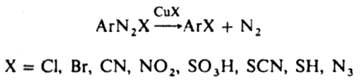
Для введения хлора или брома р-р соли диазония обычно добавляют при 0-35 °С к р-ру галогенида Cu(I) (от 0,1 до 1 моля на 1 моль диазосоединения) в галогеноводородной к-те. Выходы галогснидов 70-95%. Вместо солей меди можно применять порошок меди (р-ция Гаттермана) или соли др. металлов (напр., FeCl2). Иногда стадии диазотирования и замены диазониевой группы на галоген осуществляют без выделения промежут. продукта. Для введения нитрильной группы р-р соли диазония нейтрализуют, смешивают при охлаждении с р-ром комплексной соли Na [Сu (CN)2] или К [Сu (CN)2], затем нагревают. Выходы нитрилов обычно выше 60%. Скорость 3. р. увеличивается при введении электроноакцепторных и уменьшается при введении электронодонорных заместителей в ароматическое ядро. Побочные продукты при этой реакции - азосоединения, биарилы и фенолы. Предполагаемый механизм замены диазогруппы на галоген включает образование лабильного комплекса диазоний-катиона с солью Cu(I) (лимитирующая стадия), напр.:
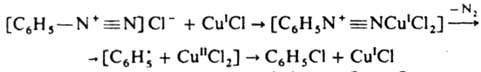
В ряду нафталина, фенантрена, бифенила 3. р. обычно дает низкие выходы галогенидов; в этих случаях используют термич. разложение двойных галогенидов диазония и ртути [ArN2]+ [HgHal3]- (р-ция Швехтена). Арилиодиды обычно получают нагреванием диазосоединений с р-ром KI, арилфториды - по Шимана реакции. 3. р. используют для пром. синтеза промежут. продуктов в произ-ве орг. красителей, напр. 8-хлор- и 8-цианонафталин-1-сульфокислот, хлортолуолов, 2-цианофенилтиогликолевых к-т. Р-ция открыта Т. Зандмейером в 1884. Лит.: Эфрос Л. С., Горелик М. В., Химия и технология промежуточных продукгов. Л., 1980. с. 334-40. Е. М. Рохлин.


