ДИОКСИАНТРАХИНОНЫ (дигидроксиантрахиноны), мол. м. 240,2. Наиб. практическое значение имеют 1,2-Д. (ализарин)и 1,4-Д. (хинизарин), а также 1,5- и 1,8-Д. (см. табл.).
Д. плохо раств. в воде, этаноле, диэтиловом эфире, раств. в конц. H2SO4, р-рах щелочей с углублением окраски. Подобно фенолам и нафтолам, ацилируются и алкилируются по гидроксигруппам, причем b-гидроксигруппы реагируют легче, чем a-гидроксигруппы. Электроф. замещение в антрахиноновое ядро происходит в орто- и пара-положения к гидроксигруппам. При сульфировании 1,5- и 1,8-Д. и дальнейшем нитровании нитрующей смесью образуются соотв. 1,5-дигидрокси-4,8-динитроантрахинон-2,6- и 1,8-дигидрокси-4,5-динитроантрахинон-2,7-дисульфокислоты промежут. продукты для получения синих дисперсных красителей, напр.:
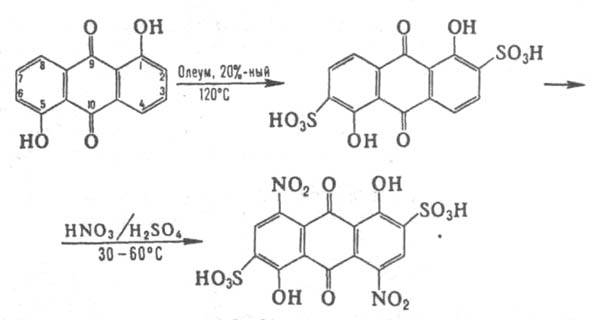
При хлорировании SO2Cl2 в нитробензоле 1,5- и 1,8-Д. образуют 1,5-дигидрокси-4,8-дихлор- и 1,8-дигидрокси-4,5-дихлорантрахиноны. Восстановление Д. в зависимости от условий приводит к дигидроксиантронам или дигидроксиантраценам. При щелочном плавлении нек-рых Д. в присут. окислителей образуются тригидроксиантрахиноны. Напр., 1,5-Д. взаимод. с NaOH и NaNO3 при 180°С в автоклаве, превращаясь в 1,2,5-тригидроксиантрахинон, а 1,6-Д. в тех же условиях - в 1,2,6-тригидроксиантрахинон.

В пром-сти 1,5- и 1,8-Д. получают: взаимод. соответствующих дисульфокислот антрахинона с СаО в присут. MgCl2 в водном р-ре при 210-230 °С и 2 МПа в течение 10-12 ч; кипячением соответствующих диметоксиантрахинонов в смеси уксусной и серной к-т; щелочной (КОН) обработкой соответствующих динитроантрахинонов при 105°С в тетраметиленсульфоне. 2,3-Д. синтезируют циклизацией 2-(3,4-дигидроксибензоил)бензойной к-ты в конц. H2SO4 при 95 °С, 2,6- и 2,7-Д. - щелочным плавлением соответствующих дисульфокислот антрахинона, 1,6- и 1,7-Д. - щелочным плавлением 1-гидрокси-6- и 1-гидрокси-7-сульфокислот антрахинона. Нек-рые замещенные 1,8-дигидроксиантрахинона используются как лек. ср-ва, аналит. реагенты (напр., 1,8-дигидрокси-3-гидроксиметилантрахинон и 1,8-дигидрокси-4,5-динитроантрахинон - цветные реагенты соотв. на Сu2+ и In), 2,6- и 2,7-Д. - катализаторы окисления в пастах кубовых красителей. Лит.. Горелик М. В., Химия антрахинонов и их производных, М., 1983. С. И. Попов.

При хлорировании SO2Cl2 в нитробензоле 1,5- и 1,8-Д. образуют 1,5-дигидрокси-4,8-дихлор- и 1,8-дигидрокси-4,5-дихлорантрахиноны. Восстановление Д. в зависимости от условий приводит к дигидроксиантронам или дигидроксиантраценам. При щелочном плавлении нек-рых Д. в присут. окислителей образуются тригидроксиантрахиноны. Напр., 1,5-Д. взаимод. с NaOH и NaNO3 при 180°С в автоклаве, превращаясь в 1,2,5-тригидроксиантрахинон, а 1,6-Д. в тех же условиях - в 1,2,6-тригидроксиантрахинон.

В пром-сти 1,5- и 1,8-Д. получают: взаимод. соответствующих дисульфокислот антрахинона с СаО в присут. MgCl2 в водном р-ре при 210-230 °С и 2 МПа в течение 10-12 ч; кипячением соответствующих диметоксиантрахинонов в смеси уксусной и серной к-т; щелочной (КОН) обработкой соответствующих динитроантрахинонов при 105°С в тетраметиленсульфоне. 2,3-Д. синтезируют циклизацией 2-(3,4-дигидроксибензоил)бензойной к-ты в конц. H2SO4 при 95 °С, 2,6- и 2,7-Д. - щелочным плавлением соответствующих дисульфокислот антрахинона, 1,6- и 1,7-Д. - щелочным плавлением 1-гидрокси-6- и 1-гидрокси-7-сульфокислот антрахинона. Нек-рые замещенные 1,8-дигидроксиантрахинона используются как лек. ср-ва, аналит. реагенты (напр., 1,8-дигидрокси-3-гидроксиметилантрахинон и 1,8-дигидрокси-4,5-динитроантрахинон - цветные реагенты соотв. на Сu2+ и In), 2,6- и 2,7-Д. - катализаторы окисления в пастах кубовых красителей. Лит.. Горелик М. В., Химия антрахинонов и их производных, М., 1983. С. И. Попов.


