ДИБЕНЗОТИОФEН (дибензо[b,d]тиофен, дифениленсульфид), мол. м. 184,26; бесцв. кристаллы; т.пл. 98,9 °С, т. кип. 332-333 °С; раств. в этаноле, эфире и бензоле; m 2,797.10-30Кл.м.
Д. термически устойчив (не разлагается до 425 °С), обладает ароматич. св-вами.
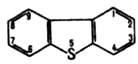
Электроф. замещение идет гл. обр. в положение 2, второй заместитель направляется в положение 8 (реакц. способность др. положений уменьшается в ряду: 3 > 4 > 1). Металлирование с помощью C4H9Li идет в положение 4 (Li в диоксане расщепляет гетероцикл). Na2Cr2O7 в орг. к-тах и Сl2 в ССl4 окисляют Д. до сульфоксида, орг. надкислоты -до сулъфона. Последний замещается по положению 3, что позволяет после восстановления сульфона с помощью LiAlH4 получать соответствующие производные Д. Сильные алкилирующие ср-ва алкилируют Д. по атому S с образованием дибензотиофениевых солей. Д. и тетрагидродибензотиофен содержатся в высококипящих фракциях нефти в кол-ве до 6-8%. Д. присутствует также в фенантрене, получаемом из кам.-уг. смол. Синтезируют Д. взаимод. дифенила с S и АlСl3 (выход 80%), а также по р-циям:
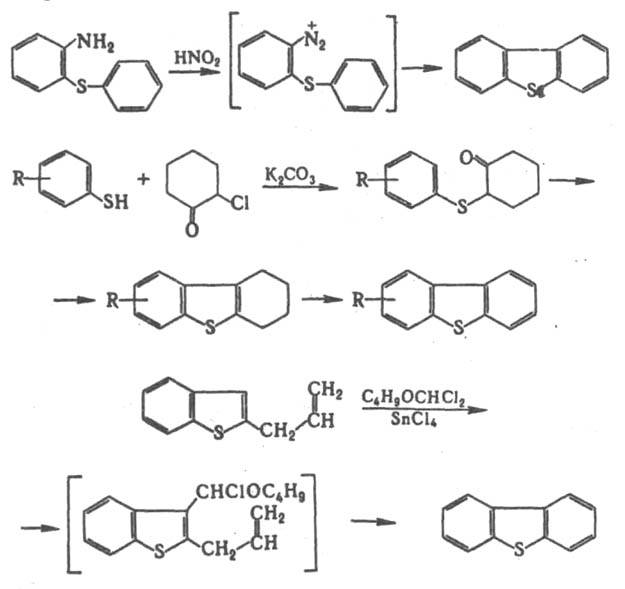
Дибензотиофенкарбоновые к-ты получают из 3-винилбензотиофена по р-ции Дильса-Альдера с послед. дегидрированием:
При взаимод. 2,2-дииодперфтордифенила с S при 320 °С образуется перфтордибензотиофен. Сульфоны Д. и нек-рых его производных увеличивают адсорбцию дисперсных красителей гидрофобными полимерами. Д. и его арилпроизводные применяют как диэлектрич. и гидравлич. жидкости. Лит.: Гетероциклические соединения, под ред. Р. Эльдерфилда, пер. с англ., т. 2, М., 1954, с. 127-33; Реакции серы с органическими соединениями, Новосиб., 1979, с. 94, 136, 139; Hartough H. D., Meisel S. L., Compounds with condensed thiophene rings, L., 1954 (The chemistry of heterocyclic compounds, N 7), p. 225-82; Ashby J.. Cook C.C., "Advances in Heterocyclic Chemistry", 1974, v. 16, p. 181-288. В.И. Шведов.

Электроф. замещение идет гл. обр. в положение 2, второй заместитель направляется в положение 8 (реакц. способность др. положений уменьшается в ряду: 3 > 4 > 1). Металлирование с помощью C4H9Li идет в положение 4 (Li в диоксане расщепляет гетероцикл). Na2Cr2O7 в орг. к-тах и Сl2 в ССl4 окисляют Д. до сульфоксида, орг. надкислоты -до сулъфона. Последний замещается по положению 3, что позволяет после восстановления сульфона с помощью LiAlH4 получать соответствующие производные Д. Сильные алкилирующие ср-ва алкилируют Д. по атому S с образованием дибензотиофениевых солей. Д. и тетрагидродибензотиофен содержатся в высококипящих фракциях нефти в кол-ве до 6-8%. Д. присутствует также в фенантрене, получаемом из кам.-уг. смол. Синтезируют Д. взаимод. дифенила с S и АlСl3 (выход 80%), а также по р-циям:

Дибензотиофенкарбоновые к-ты получают из 3-винилбензотиофена по р-ции Дильса-Альдера с послед. дегидрированием:

При взаимод. 2,2-дииодперфтордифенила с S при 320 °С образуется перфтордибензотиофен. Сульфоны Д. и нек-рых его производных увеличивают адсорбцию дисперсных красителей гидрофобными полимерами. Д. и его арилпроизводные применяют как диэлектрич. и гидравлич. жидкости. Лит.: Гетероциклические соединения, под ред. Р. Эльдерфилда, пер. с англ., т. 2, М., 1954, с. 127-33; Реакции серы с органическими соединениями, Новосиб., 1979, с. 94, 136, 139; Hartough H. D., Meisel S. L., Compounds with condensed thiophene rings, L., 1954 (The chemistry of heterocyclic compounds, N 7), p. 225-82; Ashby J.. Cook C.C., "Advances in Heterocyclic Chemistry", 1974, v. 16, p. 181-288. В.И. Шведов.


