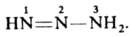 Все заместители м.б. орг. радикалами либо один из них - группой ОН (N-гидрокситриазены), NO2 (N-нитротриазены), NO (N-нитрозотриазены), СООН (триазен-N-карбоновые к-ты), SO3H (триазен-N-сульфокислоты). Наиб. значение имеют ди- и тризамещенные Д., а из них - ароматич. и жирно-ароматические.
Д. - бесцв. или желтые гл. обр. твердые в-ва. Плавятся с разл.; при 100-150°С взрываются. Хорошо раств. в орг. р-рителях; в воде раств. Д., содержащие группы СООН, SO3 или ОН. Лучший метод очистки нек-рых Д. - перегонка с водяным паром и хроматография. Для Д., как и для прочих стабильных диазосоединений, термодинамически устойчива транс-конфигурация, к-рая переходит в циc-конфигурацию при УФ облучении.
Д. - более сильные основания, чем азосоединения. При их протонировании образуется неустойчивый диазоаммониевый катион, диссоциирующий на катион диазония и амин:
Все заместители м.б. орг. радикалами либо один из них - группой ОН (N-гидрокситриазены), NO2 (N-нитротриазены), NO (N-нитрозотриазены), СООН (триазен-N-карбоновые к-ты), SO3H (триазен-N-сульфокислоты). Наиб. значение имеют ди- и тризамещенные Д., а из них - ароматич. и жирно-ароматические.
Д. - бесцв. или желтые гл. обр. твердые в-ва. Плавятся с разл.; при 100-150°С взрываются. Хорошо раств. в орг. р-рителях; в воде раств. Д., содержащие группы СООН, SO3 или ОН. Лучший метод очистки нек-рых Д. - перегонка с водяным паром и хроматография. Для Д., как и для прочих стабильных диазосоединений, термодинамически устойчива транс-конфигурация, к-рая переходит в циc-конфигурацию при УФ облучении.
Д. - более сильные основания, чем азосоединения. При их протонировании образуется неустойчивый диазоаммониевый катион, диссоциирующий на катион диазония и амин:
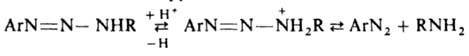
Кислотный гидролиз Д. широко используется для генерирования катионов диазония. Д., содержащие остаток ароматич. амина, у к-рого свободно пара- или орто-положение, в кислой среде в присут. соответствующего амина при 40-50°С перегруппировываются в аминоазосоединения по мсжмолекулярному механизму кислотного гидролиза (с образованием соли диазония и послед. ее азосочетанием с амином):
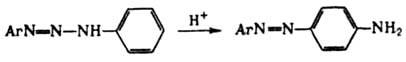
Д. проявляют также кислотные св-ва, в частности способность к N-металлированию: ArN=N—NHR + MX : ArN=N—NMR + HX, где М = Ag, Cu, Hg или др., Х = NO3, Cl, OCOCH3 или др. Металлированные Д. присоединяют NH3, пиридин, тиомочевину и др. основания, а также р-рители (напр., спирт, ацетон, воду), образуя прочные ярко окрашенные комплексы. На этом св-ве основано применение Д. как аналит. реагентов. В р-рах дизамещенные Д. благодаря водородным связям образуют линейные и циклич. ассоциаты, способствующие 1,3-переносу протона (таутомерия). Из-за таутомерии продукты гидролиза могут не отвечать исходным компонентам (перенос диазогруппы), напр.:
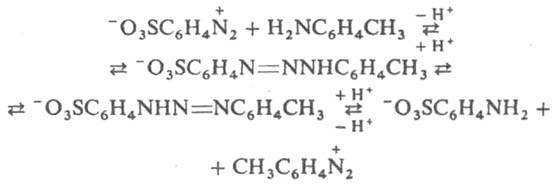
Восстанавливаются Д. обычно в производные гидразина и ариламина:
ArNH—N=N—Аr + 2Н2 : ArNH2 + ArNHNH2
Термич. распад Д. происходит с выделением N2 и своб. радикалов 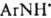 ,
, 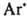 и
и 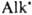 , диспропорционирование и рекомбинация к-рых со средой приводят к образованию ArNH2, АrН, Аr2 и др. углеводородов.
Осн. способ получения Д. - взаимод. солей диазония с первичными или вторичными аминами при 0-20 °С чаще всего в воде (реже - в этаноле, уксусной или муравьиной к-те, а также в полярных апротонных р-рителях, напр. ДМФА). Образование Д. по аналогии с азосочетанием следует рассматривать как электроф. замещение у атома N аминогруппы с промежут. образованием диазоаммониевого катиона, концентрация к-рого мала и постоянна:
, диспропорционирование и рекомбинация к-рых со средой приводят к образованию ArNH2, АrН, Аr2 и др. углеводородов.
Осн. способ получения Д. - взаимод. солей диазония с первичными или вторичными аминами при 0-20 °С чаще всего в воде (реже - в этаноле, уксусной или муравьиной к-те, а также в полярных апротонных р-рителях, напр. ДМФА). Образование Д. по аналогии с азосочетанием следует рассматривать как электроф. замещение у атома N аминогруппы с промежут. образованием диазоаммониевого катиона, концентрация к-рого мала и постоянна:
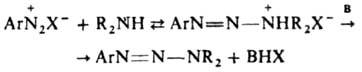
[В-р-ритель, а также основания, напр., пиридин и его аналоги, анионы слабых к-т (фталевой, уксусной и пр.)]. Т. к. скорость образования Д. в значит. степени лимитируется отрывом протона от диазоаммониевого катиона, р-ция катализируется основаниями.
Для успешного образования Д. необходимо, чтобы не происходил его гидролиз. Поэтому чем основнее Д., тем ниже должна быть кислотность среды при его образовании (получение ароматич. Д. из компонентов с электронодонорными заместителями нельзя вести в кислой среде). При взаимод. соли диазония с алифатич. амином среда должна быть слабощелочной. Если используется первичный алифатич. амин, происходит замена второго атома Н в амине с образованием бис-диазоаминосоединения (пентаза-1,4-диена) ArN=N—N(Alk)—N=NAr. Д. не образуются при р-ции соли диазония с нафтиламинами.
Многие Д. синтезируют взаимод. магнийорг. соединений с азидами:
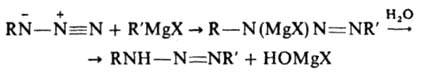
(X - галоген, R и R' - алифатич. или ароматич. радикалы).
Осн. метод анализа и идентификации ароматич. и жирно-ароматич. Д. - кислотный гидролиз с послед, азосочетанием с нафтолами и колориметрич. определение азокрасителя. Для анализа Д. используется также цветная р-ция образования кадмиевого производного.
В пром-сти Д. применяют для получения аминоазосоединений (азосоставляющая - анилин, N-алкиланилины и их производные), для крашения (компоненты диазаминолов; см. Азогены).
Д. открыты П. Гриссом в 1862.


