СН3СН2Сl D СН3СН2 + Сl Сl + НСН2СН2Сl D НСl + СН2СН2Сl
СН2СН2Сl D СН2=СН2 + Сl.
Процесс проводят при 400-500 °С, при использовании инициаторов (напр., Сl2) - на 50-100°С ниже, при использовании катализаторов (пемза, активированный уголь, силикагель, ВаСl2 и др.) - при 200-300°С.
Д. в жидкой фазе осуществляют с применением щелочей в спиртах или диполярных апротонных р-рителях, алкоголятов в спиртах или ДМСО, амидов щелочных металлов в инертных р-рителях, а также с помощью третичных аминов. Если механизм р-ции мономолекулярный, стадией, определяющей скорость процесса, является образование карбкатиона (В- - основание):
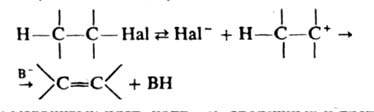
По этому механизму идет, напр., Д. вторичных и третичных алкилгалогенидов в слабоосновных, но хорошо сольватирующих р-рителях (напр., в спиртах, воде, карбоновых к-тах).
Механизм бимолекулярной р-ции можно записать в след. виде:
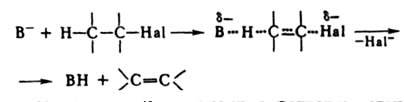
В этом случае для Д. решающим фактором становится основность реагента, к-рая в наиб. мере проявляется в апротонных диполярных р-рителях, не способных к образованию водородных связей с основанием, напр., в ДМСО. Р-ция стереoселективна: в нее вступают гл. обр. соед., у к-рых атомы Н и Hal находятся в транс-положении.
Преимуществ. направление Д., особенно в случае мономолекулярного механизма, определяется правилом Зайцева: водород отщепляется от наименее гидрогенизир. атома С. Р-ция протекает легче, если рядом с атомом Н находится электроноакцепторная группа.
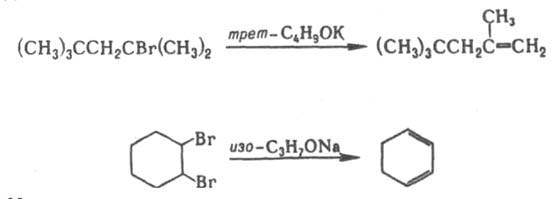
Д. в жидкой фазе используют для получения олефинов и диенов:
Из вицинальных и геминальных дигалогенопроизводных образуются винилгалогениды, из a-галогенэфиров и галогеногидринов - эфиры енолов, при действии третичных аминов на хлорангидриды к-т - кетены, напр.:
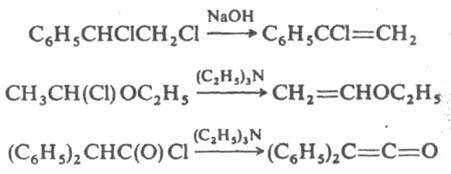
Из винилгалогенидов и 1,2-дигалогенопроизводных получают производные ацетилена, напр.:
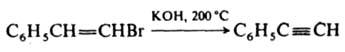
Д. винилгалогенидов и 1,2-дигалогенидов проводят либо при нагр. с щелочами или амидами щелочных металлов, либо под действием гидроксида тетрабутиламмония, генерируемого в межфазных условиях, напр., в системе пентан - водный р-р NaOH в присут. бисульфата тетрабутиламмония.
Д. с образованием циклов имеет меньшее значение. Оно используется, напр., для синтеза циклоалканов:
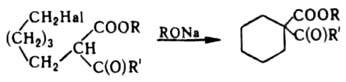
При жидкофазном Д. реакц. способность соед. возрастает в ряду: F < Сl < Вr < I и с переходом от первичного к третичному атому С; в случае газофазного процесса реакц. способность увеличивается также при возрастании числа атомов галогена у одного атома С и c удлинением углеродной цепи молекулы.
Д., в особенности в жидкой фазе, часто сопровождается побочными р-циями: замещением галогена на гидроксил, конденсацией, перегруппировками.
Д. широко используют в пром-сти для получения из хлоруглеводородов винилхлорида, хлоропрена, трихлорэтилена и винилиденхлорида.
Лит.: Матьё Ж., Панико Р., Вейль-Рейналь Ж., Изменение и введение функций в органическом синтезе, пер. с франц., М., 1980, с. 168-75; Органикум, пер. с нем., т. 1, М., 1979, с. 312-17. Н. А. Бумагин.


