ГРАНИЧНЫХ ОРБИТАЛЕЙ ТЕОРИЯ, простейший вариант возмущений теории в методе молекулярных орбиталей. Предназначена для предсказания реакц. способности соединений. С этой целью в реагирующих молекулах рассматривают т. наз. граничные молекулярные орбитали (МО)-высшую занятую и низшую свободную (соотв. ВЗМО и НСМО). В радикалах или возбужденных молекулах роль одной из этих орбиталей или их обеих могут играть однократно занятые МО. наиб. важная характеристика граничных МО-их парциальная электронная плотность, т.е. плотность на отдельных атомах, наз. граничной электронной плотностью или индексом реакц. способности. Осн. постулат теории: р-ции легче всего протекают в случае макс. перекрывания граничных МО, к-рые, как правило, вносят наиб. вклад в энергию взаимод. реагентов. Перекрывание приводит к переносу заряда с высшей занятой орбитали донора на низшую свободную акцептора. При этом положение с наиб. граничной плотностью низшей своб. орбитали, как правило, наиб. благоприятно для нуклеоф. атаки; электроф. атака протекает преим. по положению, где граничная плотность высшей занятой орбитали наибольшая. Взаимод. с переносом заряда между высшей занятой орбиталью одного реагента и низшей свободной другого приводит к возрастанию граничной плотности в области перекрывания.
Для описания реакц. способности необходимо знать только вид граничных
МО реагирующих молекул, к-рый, как правило, определяется при помощи простейших
квантовохим. расчетов (см. Молекулярных орбиталей методы). Так,
вид высшей занятой орбитали нафталина и низшей свободной иона нитрония,
имеющих макс. плотность в соположении нафталина и на атоме N иона нитрония
соотв., объясняет, почему нитрование нафталина происходит в осн. в положение
(рис. 1,а). Вид граничных МО бутадиена и этилена, имеющих одинаковую
симметрию, объясняет предпочтительность супра-супраповерхностного способа
их сближения (см. Вудворда-Хофмана правила)в диеновом синтезе (рис.
1,б). В р-циях SN2 с инверсией тетраэдрич. конфигурации
атома С рассматривают перенос заряда с высшей занятой МО нуклеофила (донора)
на низшую свободную электрофила (акцептора), представленную двухатомной
разрыхляющей МО (рис. 1,в). В этом случае только атака с тыла обеспечивает
достаточно благоприятное перекрывание граничных орбиталей. В случае мономолекулярных
р-ций рассматриваются граничные орбитали взаимодействующих фрагментов.
положение
(рис. 1,а). Вид граничных МО бутадиена и этилена, имеющих одинаковую
симметрию, объясняет предпочтительность супра-супраповерхностного способа
их сближения (см. Вудворда-Хофмана правила)в диеновом синтезе (рис.
1,б). В р-циях SN2 с инверсией тетраэдрич. конфигурации
атома С рассматривают перенос заряда с высшей занятой МО нуклеофила (донора)
на низшую свободную электрофила (акцептора), представленную двухатомной
разрыхляющей МО (рис. 1,в). В этом случае только атака с тыла обеспечивает
достаточно благоприятное перекрывание граничных орбиталей. В случае мономолекулярных
р-ций рассматриваются граничные орбитали взаимодействующих фрагментов.
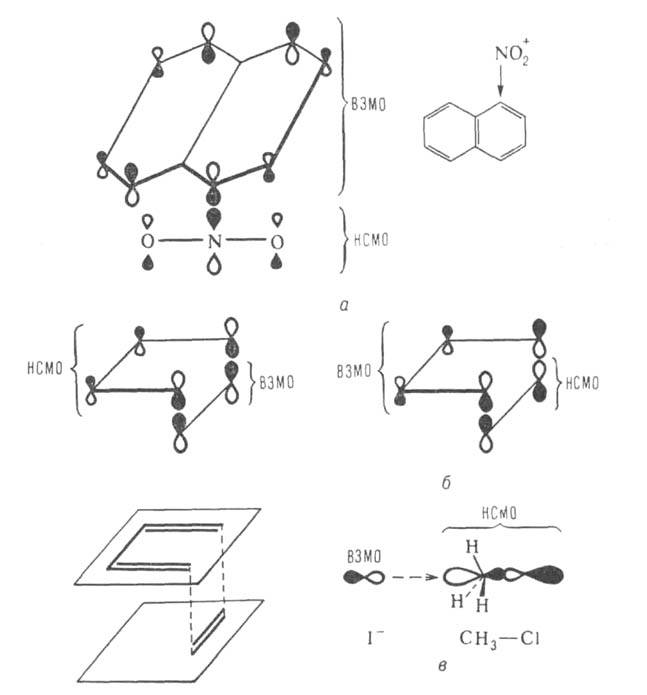
Рис. 1. Орбитальные взаимод. при нитровании нафталина (а), в диеновом синтезе (б) а также в р-ции SN2(в).
В ряде случаев невозможно четко выделить граничные орбитали, поскольку
контролировать р-цию могут несколько (или даже целые полосы) высоколежащих
занятых и низколежащих свободных МО. Так, протонирование пиридина происходит
не в положение с макс. амплитудой высшей занятой орбитали,
а по неподеленной электронной паре атома N. Г. о. т. предложена К. Фукуи
в 1952.
орбитали,
а по неподеленной электронной паре атома N. Г. о. т. предложена К. Фукуи
в 1952.
Лит.. Минкин В. И., Симкин Б. Я., Миняев P.M., Квантовая химия органических соединений. Механизмы реакций, М., 1986; Fukui К., "Science", 1982, v. 218, № 4574, р. 747-54. М.Е. Клецкий.


