ГЛИКОГЕН (от греч. glykys-сладкий и греч. -genes-рождающий, рожденный)
(С6Н10О5)„, разветвленный полисахарид,
молекулы к-рого построены из остатков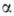 -D-глюкопиранозы
со связями 1 -> 4 в линейных участках и 1->6 в разветвлениях (ф-лу участка
молекулы Г. см. в ст. Гликозилтрансферазы). Точки ветвления во внутр.
участках молекулы расположены через 3-4 остатка моносахарида, хотя в среднем
одно разветвление приходится на 10-12 глюкозильных остатков.
-D-глюкопиранозы
со связями 1 -> 4 в линейных участках и 1->6 в разветвлениях (ф-лу участка
молекулы Г. см. в ст. Гликозилтрансферазы). Точки ветвления во внутр.
участках молекулы расположены через 3-4 остатка моносахарида, хотя в среднем
одно разветвление приходится на 10-12 глюкозильных остатков.
Г.-аморфный продукт; мол. м. 106-109,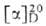 + 196° (вода); хорошо раств. в воде (р-ры опалесцируют), из к-рой осаждается
спиртом или (NH4)2SO4; раств. также в
ДМСО; характеристич. вязкость 6,5-14,3 мл/г. К-тами гидролизуется, причем
вначале образуются декстрины, а в конце р-ции - глюкоза. К действию конц.
р-ров щелочей довольно устойчив. Водные р-ры Г. окрашиваются иодом (
+ 196° (вода); хорошо раств. в воде (р-ры опалесцируют), из к-рой осаждается
спиртом или (NH4)2SO4; раств. также в
ДМСО; характеристич. вязкость 6,5-14,3 мл/г. К-тами гидролизуется, причем
вначале образуются декстрины, а в конце р-ции - глюкоза. К действию конц.
р-ров щелочей довольно устойчив. Водные р-ры Г. окрашиваются иодом (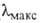 410-490 нм), что используется для качеств. обнаружения полисахарида. Образует
комплексы со мн. белками, напр. с альбумином и конканавалином А.
410-490 нм), что используется для качеств. обнаружения полисахарида. Образует
комплексы со мн. белками, напр. с альбумином и конканавалином А.
Г. содержится во всех тканях животных и человека и представляет собой
резервное в-во (в растениях такие ф-ции выполняет крахмал), легко расщепляющееся
под действием ряда ферментов до глюкозы. Обнаружен также в нек-рых бактериях,
грибах и зернах растений. У человека Наиб. богаты Г. печень (2-6% от массы
сырой ткани) и мышцы (до 2%). В тканях животных Г. присутствует в виде
частиц, наз. гликогеносомами. Наиб. крупные из них, т.н.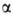 -частицы
(диам. 100-200 нм), собраны из
-частицы
(диам. 100-200 нм), собраны из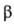 -частиц
(диам. 30-40 нм). Встречаются также еще более мелкие
-частиц
(диам. 30-40 нм). Встречаются также еще более мелкие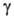 частицы (3-20 нм).
частицы (3-20 нм).
Биосинтез Г. осуществляется с помощью ферментов гликозилтрансфераз.
Исходным в-вом для синтеза может служить молекула олигосахарида, состоящая
из остатков глюкозы, или белок, глюкозилированный в результате переноса
на него остатка глюкозы с уридиндифосфатглюкозы. Г. расщепляется с помощью
фермента фосфорилазы, переносящей остаток глюкозы на фосфорную к-ту с образованием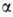 -D-глюкозо-!-фосфата, и разл. гидролаз (напр.,
-D-глюкозо-!-фосфата, и разл. гидролаз (напр.,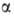 -глюкозидазы),
катализирующих гидролиз связей 1 -> 4 и 1 -> 6. Распад и синтез Г. регулируется
гормонами надпочечников и поджелудочной железы, напр. инсулином и адреналином.
-глюкозидазы),
катализирующих гидролиз связей 1 -> 4 и 1 -> 6. Распад и синтез Г. регулируется
гормонами надпочечников и поджелудочной железы, напр. инсулином и адреналином.
Г. экстрагируют из тканей 60%-ным кипящим водным р-ром КОН, холодным р-ром трихлоруксусной к-ты или смесью фенола и воды с послед. осаждением этанолом; при этом Г. частично разлагается. Нативный Г. выделяют экстракцией водой на холоду в присут. солей Hg.
Нарушение обмена Г. приводит к заболеваниям (гликогенозам), связанным с накоплением его в больших кол-вах в организме (гл. обр. в печени и сердце) или образованием молекул с отклонениями в строении.
Лит.: Степаненко Б.Н., Боброва Л.Н., "Успехи биол. химии", 1976,
т. 15, с. 195-207; Розенфельд Е. Л., Попова И. А., Гликогеновая болезнь,
М., 1979; Geddes R., Harvey G. D., Wills P. R., "Biochem. J.", 1977, v.
163, № 2, p. 201-09. M.E. Преображенская.
О-ГЛИКОЗИД-ГИДРОЛАЗЫ (гликозидазы, карбогидразы), ферменты класса гидролаз, катализирующие гидролиз О-гликозидных связей в гликозидах, олиго- и полисахаридах, гликолипидах, гликопротеинах и др. гликоконъюгатах. Г. катализируют также обратные р-ции. Эти ферменты абсолютно специфичны к конфигурации как расщепляемой, так и синтезируемой гликозидной связи. Нек-рые типы Г. катализируют перенос остатка углевода от гликозида, олиго- или полисахарида к соед., содержащему группу ОН (трансгликозилирование).
По механизму действия различают след. осн. типы Г.: гликозидазы, или
экзогликозидазы; эндогликаназы, или эндополисахаридазы; экзогликаназы,
или экзополисахаридазы. Первые отщепляют от олигомерных субстратов концевые
невосстанавливающие остатки моносахаридов. Для нек-рых из них доказан механизм,
включающий промежут. образование соединения, в к-ром фермент и остаток
углевода соединены ковалентной связью. Эндогликаназы (напр., лизоиим,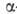 -амилаза)расщепляют в полисахаридах гликозидную связь, удаленную от невосстанавливающего
или восстанавливающего концов молекулы. Как гликозидазы, так и эндогликаназы
расщепляют гликозидную связь с сохранением конфигурации аномерного атома
углерода (C1 в циклич. форме моносахарида) и обладают трансгликозилирующей
активностью. Экзогликаиазы (напр.,
-амилаза)расщепляют в полисахаридах гликозидную связь, удаленную от невосстанавливающего
или восстанавливающего концов молекулы. Как гликозидазы, так и эндогликаназы
расщепляют гликозидную связь с сохранением конфигурации аномерного атома
углерода (C1 в циклич. форме моносахарида) и обладают трансгликозилирующей
активностью. Экзогликаиазы (напр.,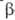 -амилаза)
отщепляют от невосстанавливающего конца полисахарида моно- или олигосахаридные
остатки с обращением их аномерной конфигурации и не обладают трансгликозилирующей
активностью. Известны также эндогликозидазы, катализирующие отщепление
олигосахаридных остатков от углеводных цепей гликопротеинов. Ниже представлен
пример расщепления углевода под действием
-амилаза)
отщепляют от невосстанавливающего конца полисахарида моно- или олигосахаридные
остатки с обращением их аномерной конфигурации и не обладают трансгликозилирующей
активностью. Известны также эндогликозидазы, катализирующие отщепление
олигосахаридных остатков от углеводных цепей гликопротеинов. Ниже представлен
пример расщепления углевода под действием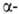 и
и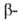 амилаз
(соотв. I и И):
амилаз
(соотв. I и И):
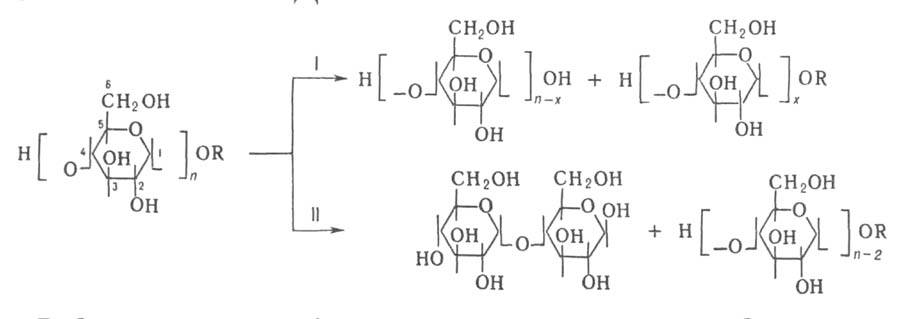
Г. обнаружены в вирусах и фагах, микроорганизмах, грибах, растениях, в клетках и тканях животных. Их главная ф-ция - участие в катаболизме сложных углеводов; они играют также важную роль в их биосинтезе (напр., крахмала, углеводных цепей гликопротеинов). Липидозы и др. болезни накопления обусловлены наследств. недостатком определенных Г.
Используют Г. как реагенты в исследованиях сложных углеводов, как лек. ср-ва (напр., гиалуронидаза - для размягчения рубцов), в кач-ве бактерицидного ср-ва при консервировании продуктов питания (лизоцим), при облагораживании продуктов питания (напр., пектиназы), при "осахаривании" крахмала (амилазы). Представляет практич. интерес проблема переработки отходов пром-сти и с. х-ва, содержащих целлюлозу, в глюкозу с помощью ферментов целлюлазного комплекса, относящихся к Г.
Лит.: Хорлин А. Я., в кн.: Структура и функции активных центров
ферментов, М., 1974, с. 39-69; Видершайн Г.Я., Биохимические основы гликозидозов,
М., 198(Х А. Я. Хорлин.


