ГИДРОЛИЗ (от греч. hydor-вода и lysis - разложение, распад),
обменная р-ция между в-вом и водой. Количественно Г. характеризуют константой
Г. (константой равновесия р-ции Г.) КГ и степенью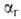 ,
представляющей собой отношение числа частиц ионов или молекул, подвергшихся
Г., к общему числу частиц, введенных в р-р. При
,
представляющей собой отношение числа частиц ионов или молекул, подвергшихся
Г., к общему числу частиц, введенных в р-р. При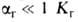 и
и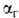 связаны друг
с другом как константа и степень ионизации электролита ,
связаны друг
с другом как константа и степень ионизации электролита ,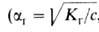 где с-концентрация р-ра в моль/л). При Г. солей образуются основания и
к-ты. В большинстве случаев это обратимая р-ция. Необратимо гидролизуются
соли, образованные катионом очень слабого основания и (или) анионом очень
слабой к-ты, напр.:
где с-концентрация р-ра в моль/л). При Г. солей образуются основания и
к-ты. В большинстве случаев это обратимая р-ция. Необратимо гидролизуются
соли, образованные катионом очень слабого основания и (или) анионом очень
слабой к-ты, напр.:
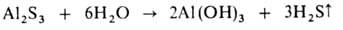
Соли, образованные катионом сильного основания и анионом сильной к-ты
(напр., LiClO4, NaNO3, KC1), в обычных условиях не
гидролизуются и для их водных р-ров рН 7.
Соли, образованные катионом сильного основания и анионом слабой к-ты (напр.,
CH3COONa), гидролизуются по аниону.
7.
Соли, образованные катионом сильного основания и анионом слабой к-ты (напр.,
CH3COONa), гидролизуются по аниону.
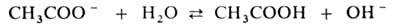
Благодаря образованию ионов ОН водные р-ры таких солей имеют щелочную
р-цию (рН > 7). Соли слабых многоосновных к-т гидролизуются ступенчато,
причем Г. по первой ступени всегда преобладает:
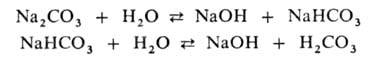
При Г. нек-рых анионов (WO42-, VO43- и др.) образуются изополианионы (напр., W3O102- , V2O74-), молекулярная масса и состав к-рых зависят от условий р-ции.
Соли, образованные катионом слабого основания и анионом сильной к-ты (напр., А1С13), гидролизуются по катиону. В р-ции участвует только катион, обычно входящий в состав аквакомплекса:

Вследствие образования гидроксоний-ионов водные р-ры таких солей имеют кислую р-цию (рН < 7). Иногда процесс не заканчивается образованием одноядерного аквагидроксокомплекса, а идет дальше с образованием осадка гидроксо- или оксосоли (редко-гидроксида). При комнатной т-ре в большинстве случаев Г. протекает с образованием остающихся в р-ре многоядерных гидроксокомплексов, состав к-рых, как правило, зависит от условий р-ции. Напр., в водных р-рах, содержащих катионы Fe3+, Be2+, Sn2+, образуются комплексы [Fe2(OH)2]4+, [Веэ(ОН)3]3+, [Sn3(OH)4]2+ .
Соли, образованные катионом слабого основания и анионом слабой к-ты, напр. Сu(ООССН3)2, гидролизуются по катиону и по аниону. P-pbi таких солей имеют слабокислую или слабощелочную р-цию в зависимости от того, какой ион гидролизуется в большей степени.
При Г. галогенангидридов образуются две к-ты — кислородсодержащая и
галогеноводородная; р-ция в большинстве случаев идет необратимо:
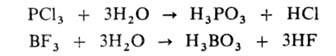
Г. орг. соединений широко используется для получения спиртов, альдегидов,
кетонов, карбоновых к-т из их производных или галогензамещенных углеводородов,
напр.:
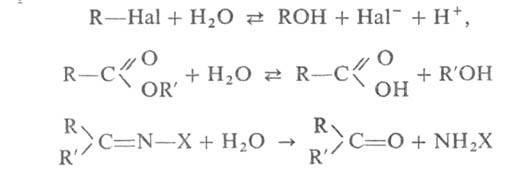
где X = Аг, ОН, NHAr и др.
Г. ускоряется в присут. к-т и оснований, а также ионов металлов, способных
прочно связываться с одним из продуктов и смещать тем самым равновесие
реакции, напр.:
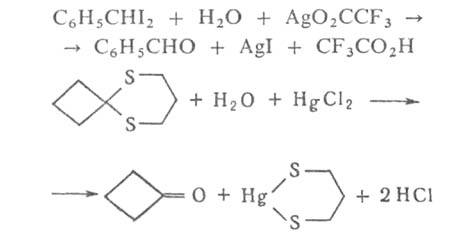
Подбор соответствующих условий и катализаторов позволяет избирательно
расщеплять отдельные связи в молекулах, содержащих неск. группировок, способных
гидролизоваться, напр.:
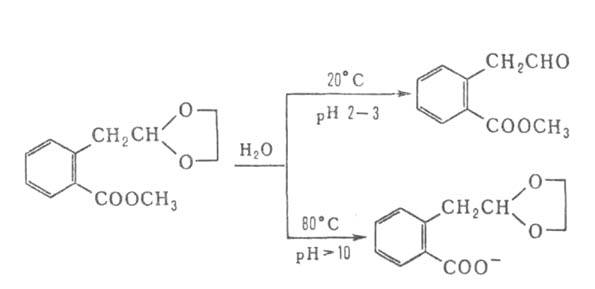
Известна обширная группа ферментов (т. наз. гидролаз), катализирующих высокоселективный Г. молекул прир. соединений. На этих процессах основано большинство методов изучения строения биополимеров.
Г. орг. соед. широко используется для получения глюкозы, этилового спирта, карбоновых кислот и др. Г. жиров -основа пром. получения мыла и глицерина. Ферментативный Г. орг. соед. применяется в пищевой, текстильной, фармацевтич. пром-сти. См. также Гидролизные производства.
Лит.: БатлерДж.Н., Ионные равновесия, пер. с англ.. Л., 1973; Ингольд К., Теоретические основы органической химии, пер. с англ., М., 1973; Днепровский А. С, Темникова Т. И., Теоретические основы органической химии, Л., 1979; Бюлер К., Пирсон Д., Органические синтезы, пер. с англ., М., 1973. С. И. Дракин. А. В. Чепраков.


